Spôsoby spájania aminokyselín v molekule proteínu
Hlavnou štruktúrnou jednotkou proteínu sú α-aminokyseliny.
Prvýkrát, už v roku 1888, A. Ya Danilevsky zistil, že aminokyseliny v molekule proteínu sú spojené skupinami -COOH a -NH2, čím sa vytvárajú väzby, neskôr nazývané peptidové väzby. Peptidová väzba vzniká interakciou karboxylovej skupiny prvej aminokyseliny s aminoskupinou na a-uhlíku druhej aminokyseliny. V tomto prípade sa molekula vody odštiepi: napríklad alanyl-alanínový dipeptid sa vytvorí z dvoch molekúl alanínu:
Zlúčenina dvoch aminokyselín sa nazýva dipeptid, jedna z troch sa nazýva tripeptid atď. Pripojenie – CO- NH- nazývaná peptidová väzba.
Ak počet aminokyselinových zvyškov nad 10, potom zavolal polypeptid, nad 50–bielkoviny. Rozlišovať N-koniec, kde je voľná skupina -NH 2 a C-koniec peptid, kde je voľná -COOH skupina aminokyseliny. Okrem skupín -COOH a -NH2, ktoré sa podieľajú na tvorbe peptidovej väzby, obsahujú aminokyseliny ďalšie funkčné skupiny umiestnené v bočných vetvách molekuly proteínu:
|
kyselina asparágová a glutámová |
|
|
lyzín, oxylyzín, |
|
|
|
guanidylová skupina arginínu |
|
|
imidazolová skupina histidínu |
|
serín a treonín |
|
|
|
fenolová skupina tyrozínu |
|
sulfhydrylová skupina cysteínu |
|
|
tioéterová skupina metionínu |
|
|
benzénový kruh fenylalanínu |
|
|
alifatické reťazce iných aminokyselín atď. |
Skupina atómov v molekulách aminokyselín, ktoré sa nezúčastňujú na tvorbe peptidovej väzby, sa nazývajú aminokyselinové radikály. Existujú aminokyseliny s radikálovými iónmi. Do tejto skupiny patrí 7 aminokyselín s radikálmi s negatívnym alebo pozitívnym nábojom, vrátane. kyseliny asparágové a glutámové s nábojom „-“, tyrozín a cysteín môžu tiež niesť náboj „-“; lyzín, arginín a histidín nesú „+“ náboj.
Polárne radikály majú sériu a treonín (-OH). Patrí sem aj asparagín, glutamín. Tretia skupina aminokyselín má nepolárne alifatické alebo aromatické radikály (alanín, valín, leucín, izoleucín, metionín, fenylalanín, tryptofán, prolín, hydroxyprolín). Pri budovaní štruktúry molekuly proteínu sú teda okrem tvorby peptidovej väzby dôležité vlastnosti aminokyselinových radikálov.
Peptidy - majú Mm až 5000 daltonov (50 aminokyselinových zvyškov), prechádzajú cez semipermeabilnú membránu. V prírode je známych viac ako 200 peptidov, vrátane v tele zvierat a ľudí, ktoré rozlišujú:
1. Peptidy-hormóny: vazopresín, oxytocín, kortikotropín, glukagón, kalcitonín, melanostimulačný hormón.
2. Peptidy podieľajúce sa na trávení – gastrín, sekretín – spolu 12 peptidov.
Z. Angiotenzín (vazokonstriktor), bradykinín.
4. Neuropeptidy.
b) Peptidy s nízkou molekulovou hmotnosťou (Mm 4 kDa), vďaka ktorým sú zvieratá odolné voči rôznym infekciám a majú široké spektrum antimikrobiálnej aktivity.
Existujú peptidy získané syntézou. Napríklad syntetická peptidová vakcína proti FMD je odvodená zo 16 aminokyselinových zvyškov. Neproteínová časť redox enzýmu je tripeptid: je to glutatión (γ-glutamyl-cysteinyl-glycín):
karnozín: β-alanyl-histidín a anserín-metyl-karnozín sú dipeptidy: zosilňujú svalové kontrakcie, majú antioxidačné a membránu stabilizujúce vlastnosti. Peptidy z glycínu a prolínu ovplyvňujú zrážanlivosť krvi, chránia sliznicu žalúdka, ovplyvňujú mozog. Endotelínové peptidy regulujú cievny tonus.
dipeptid aspartám(asparagín + fenylalanín) sa získa metódou genetické inžinierstvo. Je 300-krát sladší ako cukor, pridáva sa do nápojov namiesto cukru (Coca-Cola).
Existujú 4 úrovne štruktúry molekuly proteínu.
Primárna štruktúra proteínu - ide o poradie (striedanie) aminokyselinových zvyškov v peptidovom reťazci. Na tvorbe tejto štruktúry sa podieľajú peptidové väzby, čiastočne disulfidové väzby. Primárna štruktúra je zakódovaná v génoch, určuje zostávajúce úrovne organizácie proteínov. Primárnu štruktúru inzulínového proteínu prvýkrát určil Sanger (1953). Teraz bola študovaná primárna štruktúra veľkého počtu proteínov. Napríklad molekula inzulínu pozostáva z dvoch častí: A-21, B-30 aminokyselinových zvyškov.
Jeho štruktúra môže byť reprezentovaná nasledovne:
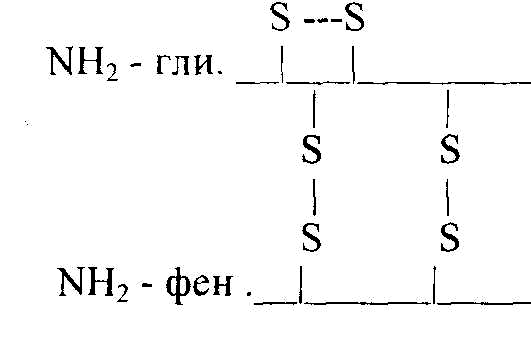 asp. COOH A reťazec (21 aminokyselinových zvyškov)
asp. COOH A reťazec (21 aminokyselinových zvyškov)
COOH v reťazci (30 aminokyselinových zvyškov)
Disulfidové väzby sa tvoria medzi reťazcami A a B a v rámci reťazca A. Primárna štruktúra RNázy so 124 aminokyselinovými zvyškami je znázornená na obr. 2.2.
Štúdium primárnej štruktúry hemoglobínu umožnilo zistiť, že kosáčikovitá anémia (obr. 2.3.) - ochorenie krvi - je spôsobená nahradením len jednej jedinej aminokyseliny v B reťazci 146 aminokyselinových zvyškov.
Ak je valín namiesto kyseliny glutámovej v polohe 6 od N-konca, potom takýto hemoglobín nevykonáva funkciu transportu kyslíka:
4 5 6 7 - poloha aminokyselín
Tre - pro - glu - liz - norm
Tre - pro - hriadeľ - liz - patológia
Sekundárna štruktúra proteínu je spôsob uloženia polypeptidového reťazca v špirálovej konfigurácii. Toto pokladanie prebieha podľa programu stanoveného v primárnej štruktúre.

Obr. 2.2. Primárna štruktúra RNázy. Farebne sú zvýraznené štyri disulfidové väzby.

2.3 Normálne a kosáčikovité erytrocyty
Pauling a Corey zistili, že globulárne proteíny tvoria α-helix vďaka vodíkovým väzbám medzi radikálmi aminokyselín. Vodíková väzba vzniká v dôsledku karbonylovej skupiny jedného radikálu a amínovej skupiny iného radikálu medzi atómami kyslíka a vodíka, dusíka a vodíka:
Karbonylová skupina a skupina NH sú schopné tvoriť medzi sebou vodíkovú väzbu. Atómy kyslíka a vodíka v peptidovej skupine zaberajú trans polohu a je možná voľná rotácia okolo - CH:
![]()
Výsledkom je, že tvorba vodíkových väzieb určuje špecifický tvar peptidu. Existujú tri typy sekundárnej štruktúry peptidových reťazcov: α-helix, β-štruktúra (zložená vrstva), náhodná špirála.
α-helix je pravotočivá cievka (obr. 2.4).
Každý závit obsahuje 3,6 aminokyselín 5,4 A (1,5 A na 1 aminokyselinu), každých 5 závitov (18 aminokyselinových zvyškov) sa štruktúrna konfigurácia opakuje, fibrilárne proteíny majú α-helikálnu štruktúru - keratíny vlasov, vlny, kože, kde -S-S- väzby poskytujú vysokú pevnosť.
V zloženej vrstve (β-štruktúra) sú peptidové reťazce usporiadané navzájom paralelne v jednej vrstve, čím vytvárajú tvar harmoniky alebo listu. Vrstva môže byť tvorená dvoma alebo viacerými peptidmi.
domény predstavujú suprasekundárnu štruktúru (obr. 2.5).
Vodíková väzba sa môže vytvoriť nielen medzi karbonylovou skupinou (negatívny náboj kyslíka) a atómom vodíka iminoskupiny \u003d NH iného polypeptidového reťazca, ale aj medzi dvoma hydroxylovými skupinami.
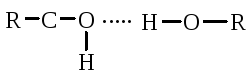
a hydroxylová skupina serínu a tyrozínu.
sekundárna štruktúra kolagén. Množstvo kolagénu v tele je 1/3 (šľachy, väzy, kĺbové puzdrá a pod.) z celkového množstva bielkovín.
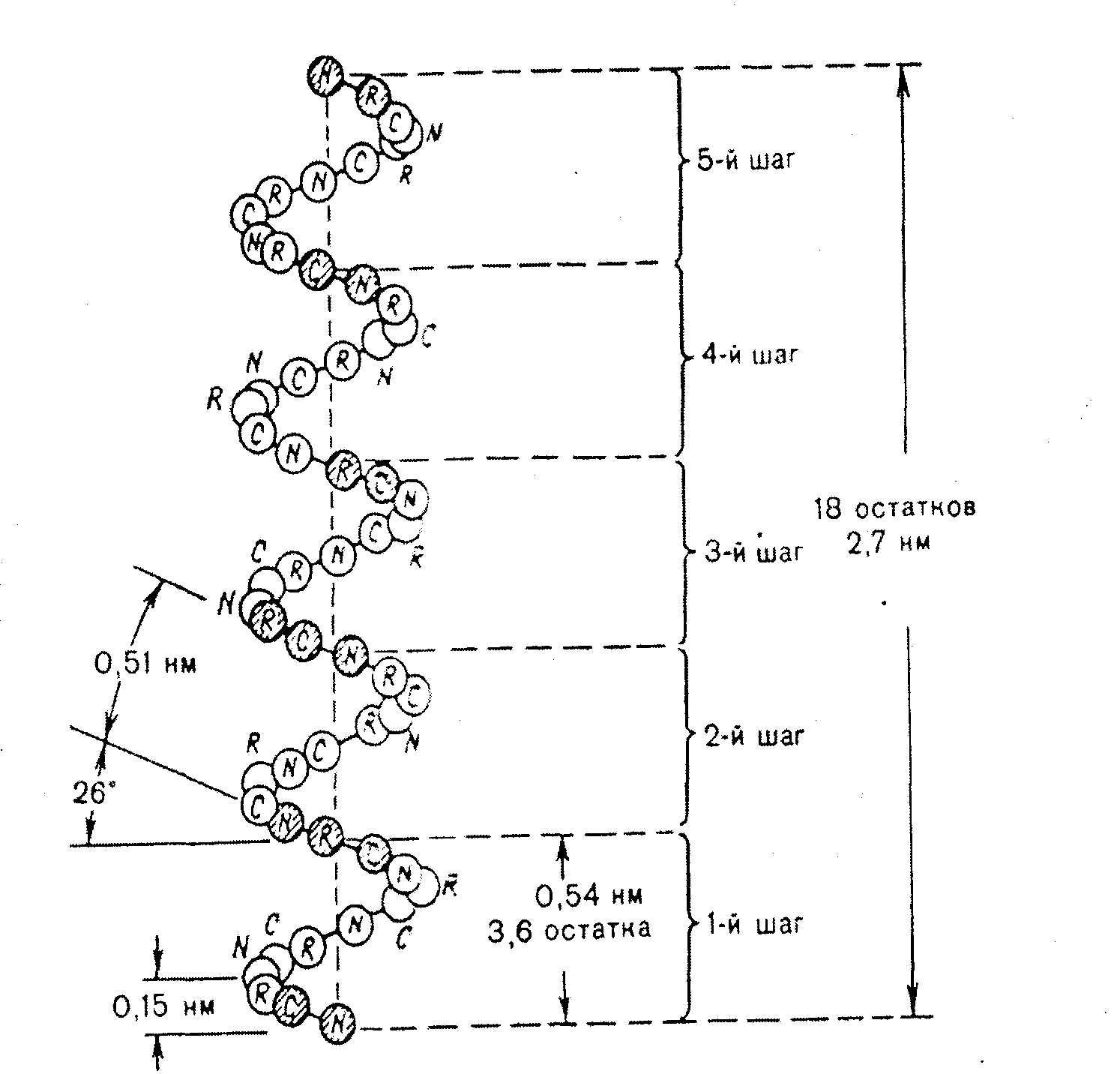
Ryža. 2.4. Štruktúra a parametre α-helixu.
Na rozdiel od α-helixu keratínov sa kolagén ťažko naťahuje. Kolagén obsahuje veľa glycínu – 1/3 z celkového počtu aminokyselinových zvyškov, 1/4 a viac tvoria prolín a hydroxyprolín. Tieto aminokyseliny narúšajú schopnosť polypeptidových reťazcov vytvárať a-helix. V kolagéne sú každé 3 polypeptidové reťazce skrútené a tvoria trojitú špirálu.
Terciárna štruktúra veverička. Ide o priestorovú orientáciu polypeptidovej špirály alebo spôsob, akým je polypeptidový reťazec uložený v určitom objeme.
Prvý proteín, ktorého terciárnu štruktúru objasnil Angličan J. Kendrew. Ide o myoglobín vorvaňa s molekulovou hmotnosťou 16700 Da, obsahuje 153 aminokyselinových zvyškov. Má jeden polypeptidový reťazec. Polypeptidový reťazec je prezentovaný vo forme zakrivenej trubice, kompaktne položenej okolo hemu (neproteínová zložka obsahujúca železo).
V súčasnosti, vďaka zvýšeniu účinnosti röntgenovej difrakčnej analýzy, bola dešifrovaná terciárna štruktúra mnohých proteínov.

Domény zloženej vrstvy
Ryža. 2.5. Schéma skladanej vrstvy a domén.
Niektoré typy väzieb, ktoré stabilizujú terciárnu štruktúru, sú znázornené na obrázku 2.6. peptid
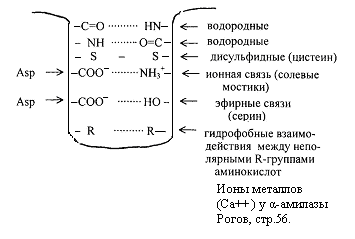
Obr.2.6. Väzby, ktoré stabilizujú sekundárnu a terciárnu štruktúru.
Terciárnu štruktúru zabezpečujú peptidové a disulfidové väzby, ale hlavnú úlohu zohrávajú nekovalentné väzby – vodík, medzimolekulové Van der Waals-Londýnské sily, hydrofóbne interakcie atď.
Terciárna štruktúra proteínu nastáva po dokončení jeho syntézy na ribozómoch automaticky. Je určená primárnou štruktúrou – sekvenciou aminokyselinových zvyškov v polypeptidovom reťazci. Terciárna štruktúra je spojená s biologickou aktivitou molekuly proteínu (katalytická, hormonálna, antigénna atď.). Akékoľvek fyzikálne a chemické vplyvy vedúce k porušeniu vodíkových väzieb, ako aj niektorých iných väzieb, a tým k deštrukcii natívnej konformácie molekuly, sú sprevádzané čiastočnou alebo úplnou stratou biologických vlastností proteínu (obr. 2.7. ).
Kvartérna štruktúra veverička. Ide o ukladanie jednotlivých polypeptidových reťazcov s rovnakou (alebo odlišnou) primárnou, sekundárnou a terciárnou štruktúrou v priestore a vznik jednej makromolekulárnej formácie. Každý jednotlivý polypeptidový reťazec (protomér) najčastejšie nemá biologickú aktivitu. Biologická molekula získava túto schopnosť určitým spôsobom priestorovej asociácie svojich protomérov tvoriacich multimér.
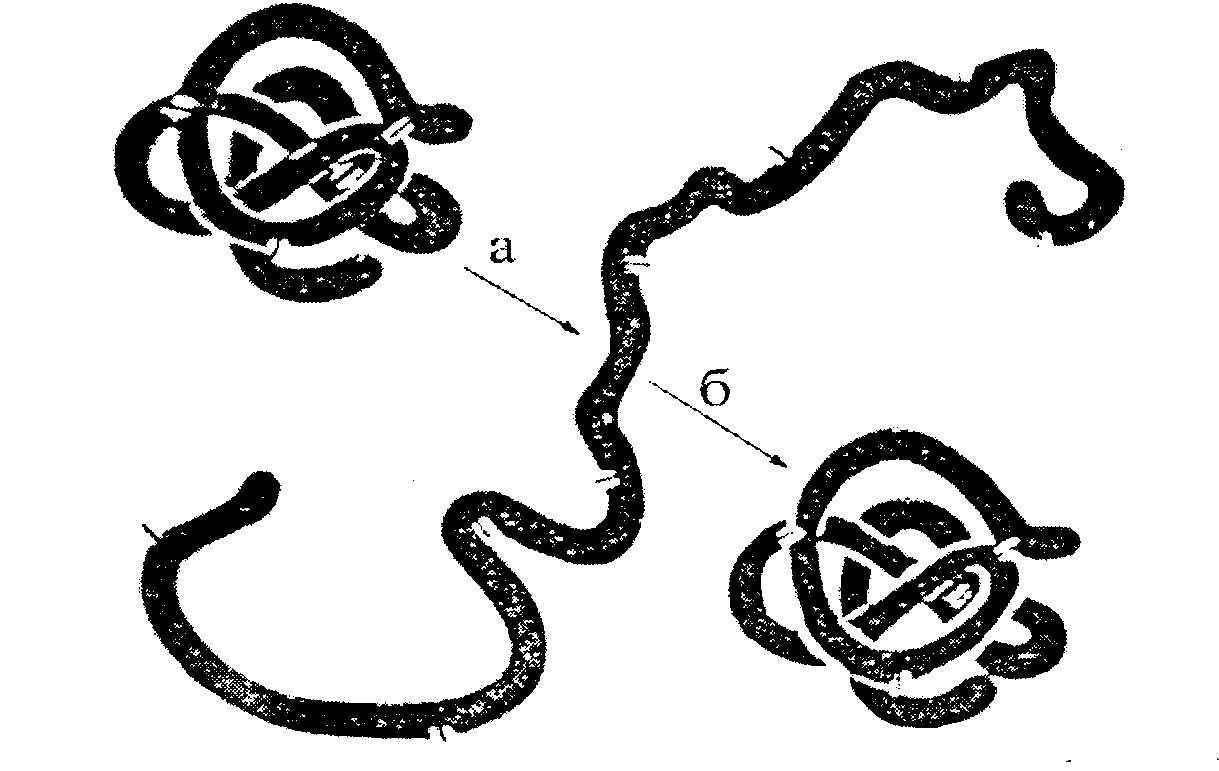
Obr.2.7. Denaturácia a renaturácia ribonukleázy (podľa Anfinsena).
a - nasadenie (močovina + merkaptoetanol);
b - prekladanie
Napríklad molekula hemoglobínu pozostáva z α- a β-podjednotiek, z ktorých každá pozostáva z dvoch polypeptidových reťazcov. Každý zo 4 polypeptidov obklopuje hemovú skupinu obsahujúcu atóm železnatého železa. Za určitých podmienok v prítomnosti solí, močoviny, zmien pH, molekúl; hemoglobín sa reverzibilne disociuje na 2 α- a 2 β-reťazce, čo je spojené s rozpadom vodíkových väzieb. Po odstránení solí, močoviny, sa pri zmene pH automaticky obnoví pôvodná molekula (obr. 2.8).
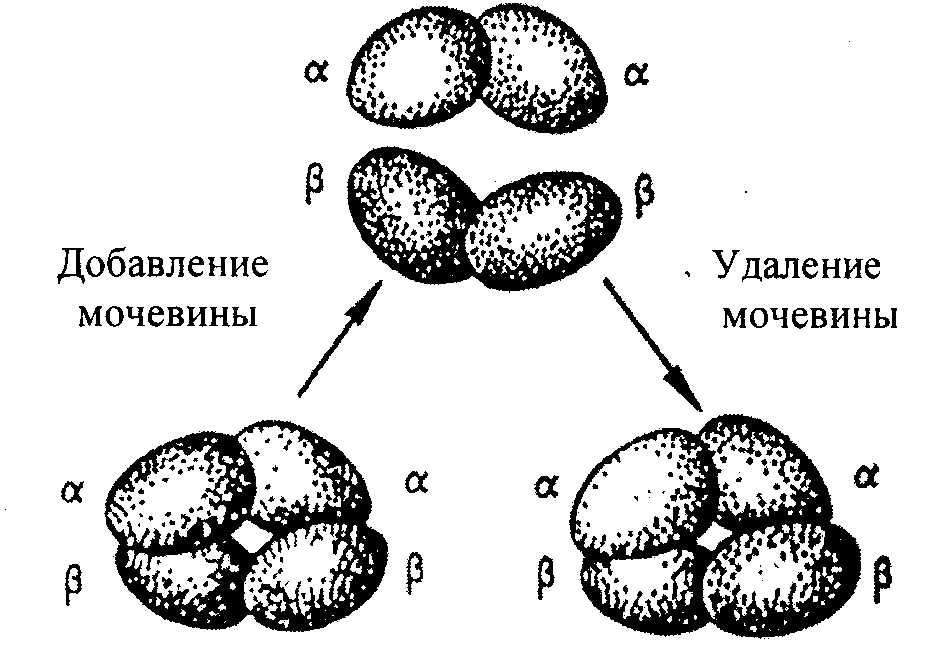
Obr.2.8. Reverzibilná disociácia molekuly hemoglobínu.
Proteín vírusu tabakovej mozaiky má obrovskú molekulu s molekulovou hmotnosťou asi 40 x 10 b Da, vírus pozostáva z 1 molekuly RNA a 2130 proteínových podjednotiek s molekulovou hmotnosťou každej 17500 Da. Okolo RNA sú proteínové podjednotky, ktoré tvoria špirálovitú štruktúru, ktorá má 130 závitov. Po pridaní detergentov môže byť RNA odstránená; čo je najprekvapujúcejšie - vírusové častice sa môžu po odstránení čistiacich prostriedkov opäť automaticky zhromaždiť. Zároveň sa obnovia aj biologické vlastnosti vírusu, infekčnosť, antigénna aktivita atď. (obr. 2.9.).
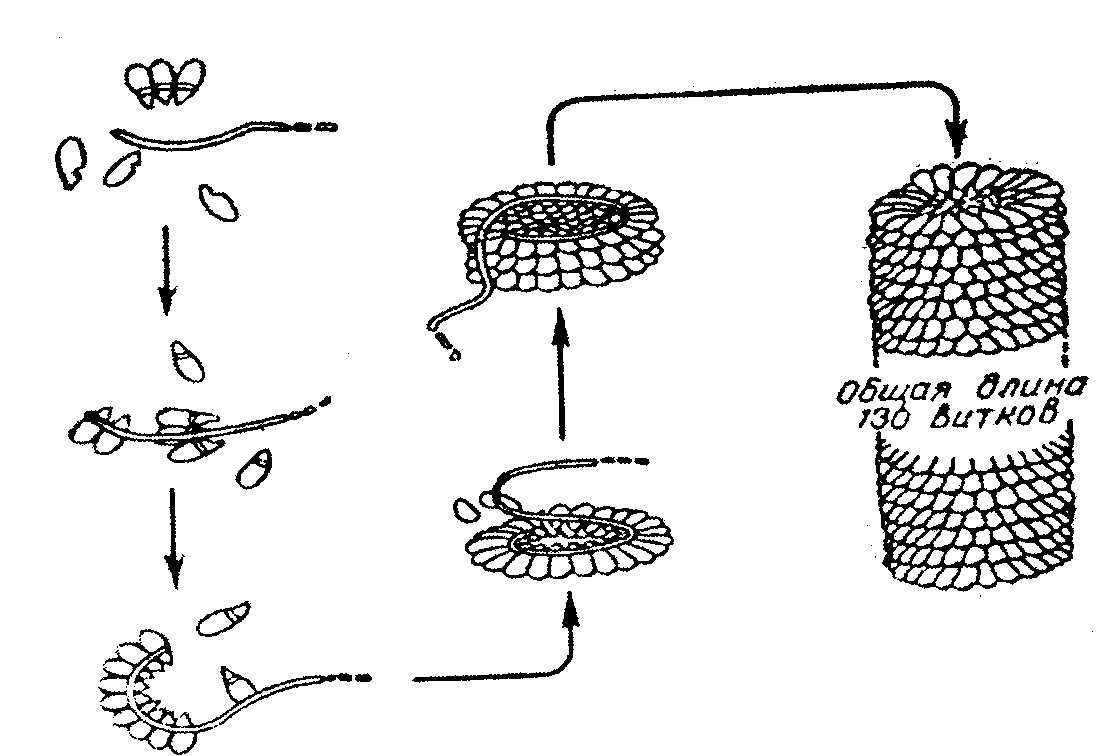
Ryža. 2.9. Vlastné zostavenie vírusu tabakovej mozaiky.
Mikrotubuly sú prítomné vo všetkých bunkách. Neustále sa rozkladajú, potom sa znovu tvoria, zúčastňujú sa na vnútrobunkovom transporte látok, na pohybe chromozómov pri delení buniek. Sú postavené z tubulínu, ktorý pozostáva z dvoch peptidov s Mm 111500 Da. Môžu byť izolované z buniek; pôsobením Mg 2+ vznikajú mikrotubuly.
Ribozómy, bunkové membrány sú tiež tvorené z niekoľkých polypeptidov (protomérov), ktoré sa navzájom stohujú a vytvárajú kvartérnu štruktúru.
V polovici 80. rokov sa zistilo, že v bunke existuje špeciálna kategória proteínov, ktorých hlavnou funkciou je zabezpečiť správny charakter poskladania polypeptidových reťazcov do natívnej štruktúry. Tieto proteíny sa nazývajú "molekulárne chaperóny". Pozostávajú z polypeptidov usporiadaných do dvoch sedemčlenných kruhov pod sebou. V strede takto skonštruovaného valca je dutina - kanál (priemer 45 angstromov), v ktorom dochádza k skladaniu polypeptidového reťazca. Okrem toho sa na skladaní molekuly proteínu podieľajú foldázové enzýmy, ktoré katalyzujú tvorbu disulfidových väzieb a izomérne transformácie niektorých stabilných trans-peptidyl-prolylových väzieb do cis-konfigurácie potrebnej pre funkčnú aktivitu.
Dobrý deň moji milí čitatelia. Som s vami, Galina Baeva, a dnes budeme hovoriť o štruktúre a funkciách molekúl bielkovín.
Prečo je to potrebné, tento proteín? Dokážeme sa bez toho zaobísť?
Nie, nebudeme. Bradatý zakladateľ dialektického materializmu Friedrich Engels povedal: život je spôsob existencie proteínových tiel. Inými slovami, bielkoviny sú život, bielkoviny neexistujú – žiaľ, ach. Normálne je to proteín 50%, tie. polovice suchej hmoty bunky a zo suchej hmoty ľudského tela sa pohybujú od 45% .
Štrukturálne vlastnosti bielkovín im umožňujú ukázať sa rôzne vlastnostičo určuje ich rozmanité biologické funkcie
Proteíny sa inak nazývajú proteíny, sú to jedno a to isté.
Čo robia proteíny v tele?
- Bielkoviny sú stavebnými kameňmi nášho tela. Sú štrukturálnymi prvkami bunkových membrán (lipoproteíny, glykoproteíny) a extracelulárnych štruktúr. Kolagén tvorí šľachy, je zodpovedný aj za elasticitu pokožky, keratín tvorí vlasy a nechty.
- Proteíny transportujú dôležité prvky do celého tela. Hemoglobín prenáša kyslík z pľúc do všetkých orgánov a tkanív a z nich odoberá oxid uhličitý, albumínový proteín nesie mastné kyseliny a špeciálne bielkoviny cholesterol. Bunkové membrány obsahujú proteíny, ktoré zabezpečujú prenos určitých látok a iónov z bunky do extracelulárneho priestoru a naopak.
- Hormóny – špeciálne látky, ktoré regulujú metabolické procesy – sú bielkovinovej povahy. Napríklad hormón inzulín poháňa cukor z krvnej plazmy do buniek.
- Proteíny chránia telo pred cudzími látkami. Gamaglobulíny neutralizujú mikróby, interferóny potláčajú reprodukciu vírusov. Fibrín zastavuje krvácanie.
- Proteíny zabezpečujú kontrakciu motorických svalov a iných kontrakčných tkanív. Aktín a myozín sú súčasťou svalov tela, troponín, tropomyozín - svaly srdca.
- Proteíny prijímajú signály z vonkajšieho prostredia a prenášajú príkazy do bunky. Signálne proteíny pod vplyvom faktorov prostredia menia svoju terciárnu štruktúru, čo následne spúšťa reťazec biochemických procesov. Rodopsín takto reaguje na svetlo, pričom premieňa svetelnú energiu na elektrickú energiu, ktorá sa prenáša nervovými bunkami do mozgu, kde vzniká vizuálny obraz.
- Proteíny sú enzýmy - katalyzátory, vďaka ktorým je možný výskyt biochemických reakcií nízke teploty(37 °C).
- Proteíny – regulátory zapínajú a vypínajú bunkové gény, čím potláčajú alebo aktivujú biochemické procesy.
- Proteíny sa spravidla nehromadia v tele, s výnimkou vaječného albumínu a mliečneho kazeínu. V tele nie sú žiadne bielkoviny navyše. Môžu sa však kombinovať s inými látkami a stopovými prvkami, čím bránia ich odstráneniu z tela. Feritín teda tvorí komplex so železom, ktorý sa uvoľňuje pri rozklade hemoglobínu, a znovu ho začleňuje do biologických procesov.
- Proteíny môžu poskytnúť energiu. Pri rozklade 1 g bielkovín sa uvoľnia 4 kcal (17,6 kJ). Ako zdroj energie sa bielkoviny využívajú pri vyčerpaní iných, normatívnych zdrojov – sacharidov a tukov. Aby sme parafrázovali D.I. Mendelejeva, môžeme povedať, že utopiť sa bielkovinami je ako utopiť sa bankovkami, tie sú pre telo také cenné.
Čo je to molekula života?
Ide o dlhú reťaz, t.j. polymér, pozostávajúci z monomérov - aminokyselín. Prečo aminokyseliny? Pretože každá molekula má koniec organickej kyseliny C-O-OH a aminoskupinu NH2. V polymérnom reťazci každý aminokyselinový monomér pripojí svoj kyslý zvyšok k aminoskupine iného monoméru, čo vedie k silnej väzbe tzv. peptid.
Pojmy proteín a peptid sú si blízke, ale nie ekvivalentné. Peptidy sa zvyčajne označujú ako určitá sekvencia aminokyselinových zvyškov. Izolujú sa oligopeptidy - krátke reťazce 10-15 aminokyselín a polypeptidy - dlhé reťazce aminokyselinových sekvencií. Proteín je polypeptid, ktorý má špeciálnu formu priestorovej organizácie.

Navliekaním aminokyselín ako guľôčok do náhrdelníka, a primárna štruktúra proteínu tie. sekvencia aminokyselinových zvyškov.\
Vo vesmíre proteín neexistuje vo forme podlhovastého vlákna, ale špirálovito sa krúti, t.j. tvary sekundárna štruktúra.

Špirála sa zmení na guľu - guľu, to už je terciárna štruktúra proteínu.
Niektoré bielkoviny (nie všetky) majú kvartérna štruktúra kombinujúci vo svojom zložení niekoľko molekúl, z ktorých každá má svoju vlastnú primárnu, sekundárnu a terciárnu štruktúru.
Prečo to potrebujete vedieť? Pretože trávenie a asimilácia bielkovín priamo závisí od ich štruktúry: čím hustejšia je bielkovina v zložení potravinového výrobku, tým je ťažšie ju stráviť, tým viac energie sa musí minúť na jej asimiláciu.
Rozpad väzieb v molekule proteínu je tzv denaturácia. Denaturácia môže byť reverzibilná, keď proteín obnoví štruktúru, a nevratná. Bielkoviny prechádzajú nezvratnou denaturáciou, aj keď sú vystavené vysokým teplotám – pre človeka je to nad 42 0 C, preto je horúčka životu nebezpečná.
Bielkoviny podrobujeme riadenej denaturácii počas varenia, keď varíme mäso alebo ryby, varíme mlieko, smažíme alebo varíme vajcia, varíme obilniny a pečieme chlieb. Pri miernej teplote sa bielkoviny s prerušenými väzbami stávajú prístupnejšie pre tráviace enzýmy a telo ich lepšie vstrebáva. Pri dlhšom a drsnom vystavení teplote - vyprážanie na drevenom uhlí, predĺžené varenie - dochádza k sekundárnej denaturácii proteínu s tvorbou nestráviteľných zlúčenín.
Aminokyseliny
Existuje viac ako dvesto rôznych aminokyselín, ale iba dvadsať sa neustále nachádza v zložení bielkovín - polymérov. Týchto 20 „magických“ aminokyselín sa delí na dve nerovnaké skupiny: neesenciálne, t.j. tie, ktoré si telo dokáže vyrobiť samo, a nenahraditeľné (nevyhnutné), ľudské telo si ich nevyrába a musíme ich bezpodmienečne získavať potravou.
Medzi neesenciálne aminokyseliny patria: alanín, arginín, aspargín, kyselina asparágová, glycín, glutamín, kyselina glutámová, prolín, serín, tyrozín, cystín.
Esenciálne aminokyseliny: valín, izoleucín, leucín, lyzín, metionín, trionín, tryptofán, fenylalanín
Pre deti sú esenciálne aminokyseliny arginín a histidín.
Aminokyseliny budú samostatným príspevkom.
Klasifikácia bielkovín
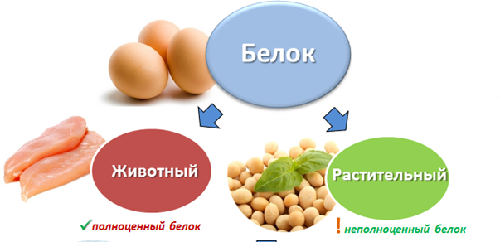
Kompletný proteín obsahuje vo svojom zložení všetky potrebné aminokyseliny a neúplný proteín teda neobsahuje žiadne aminokyseliny.
Pre stavbu všetkých telesných bielkovín je dôležitá nielen prítomnosť všetkých aminokyselín, ale aj ich zastúpenie v potravine. Optimálna je potravina, ktorá je zložením aminokyselín najbližšia bielkovinám ľudského tela. Ak jedna aminokyselina chýba, ostatné aminokyseliny telo nedokáže využiť, navyše na kompenzáciu nedostatku sa začnú štiepiť ich vlastné bielkoviny, predovšetkým bielkoviny – enzýmy zapojené do procesov biosyntézy a svalové bielkoviny. V podmienkach nedostatku jednej alebo druhej esenciálnej aminokyseliny sa ostatné aminokyseliny ukážu ako nadmerné, hoci tento prebytok je relatívny. Rozpadajúce sa svalové bielkoviny tvoria vysoko toxické produkty látkovej premeny a telo ich intenzívne vylučuje, tvoria negatívna dusíková bilancia.Človek začína slabnúť, hoci môže úprimne veriť, že s jeho výživou je všetko v poriadku.
Podľa pôvodu sa bielkoviny delia na živočíšne a rastlinné.
Živočíšne bielkoviny zahŕňajú bielkoviny vajec, mlieka a mliečnych výrobkov, rýb a morských plodov, mäsa zvierat a vtákov.
Rastlinné bielkoviny zahŕňajú bielkoviny z obilnín, strukovín, orechov a húb.
Jedlo sa považuje za bielkovinu, ak obsahuje aspoň 15 % bielkovín.
Všetky živočíšne bielkoviny sú kompletné, t.j. obsahujú kompletnú sadu aminokyselín. Väčšina rastlinných bielkovín je neúplná.
Pri nedostatočnom príjme bielkovín z potravy vznikajú v organizme degeneratívne procesy spojené s neschopnosťou vykonávať potrebné funkcie. V prvom rade trpí imunita. Človek sa stáva predisponovaným k vírusovým a bakteriálnym infekciám, choroby sa stávajú zdĺhavými, chronickými. Vlasy začínajú vypadávať, pokožka je ochabnutá, vráskavá. Vôľová sféra trpí, apatia pokrýva človeka, úplná neochota robiť čokoľvek, pripája sa depresia. Znižuje sa svalová hmota metabolizmus sa spomaľuje. Začínajú sa problémy s trávením, tzv. „syndróm dráždivého čreva“, kedy jedenie sprevádza plynatosť, hnačku vystrieda zápcha a naopak. Reprodukčná funkcia je potlačená, u žien sa zastaví menštruácia. V závažných prípadoch začínajú štrukturálne zmeny v orgánoch a tkanivách, viditeľné vyčerpanie. Hladovanie bielkovín u detí vedie k mentálna retardácia.
Ťažký proteínový hlad v našej dobe v civilizovaných krajinách, kam zaraďujeme aj našu krajinu, ak vylúčime choroby ako tuberkulóza či onkológia, nastáva u ľudí praktizujúcich šialené hladovky v manickej túžbe schudnúť.
Posledná správa sa týkala Angeliny Jolie, hospitalizovali ju s váhou 35 kg – takto našli sovietski osloboditelia väzňov nacistických koncentračných táborov. Je nepravdepodobné, že živé kostry boli príkladmi krásy.
Nedostatok bielkovín však nie je až taký zriedkavý stav v dôsledku nezdravého spôsobu stravovania, ktorý sa vyvinul v dôsledku relatívne vysokých nákladov na proteínové produkty. V snahe ušetriť ľudia prechádzajú na sacharidovo-tukovú diétu s konzumáciou závadných rastlinných bielkovín. Prispievajú k tomu polotovary vyrobené zo surogátov a nebielkovinové produkty. Takže človek, ktorý si kupuje hotové rezne, klobásy, klobásy, môže úprimne veriť, že prijíma dostatok bielkovín. Neurobiť chybu.
V ďalšom článku sa dozviete, koľko a akých bielkovín človek potrebuje, aby zostal zdravý.
Zanechajte komentáre, zdieľajte informácie sociálne siete. Galina Bayeva.
Proteíny sú jedným z dôležitých organických prvkov každej živej bunky tela. Vykonávajú mnohé funkcie: podporné, signalizačné, enzymatické, transportné, štrukturálne, receptorové atď. Primárne, sekundárne, terciárne a kvartérne štruktúry sa stali dôležitými evolučnými adaptáciami týchto molekúl? Prečo je správna konformácia bielkovín v bunkách tela taká dôležitá?
Štrukturálne zložky bielkovín
Monoméry akéhokoľvek polypeptidového reťazca sú aminokyseliny (AA). Tieto organické zlúčeniny s nízkou molekulovou hmotnosťou sú v prírode celkom bežné a môžu existovať ako nezávislé molekuly, ktoré vykonávajú svoje vlastné funkcie. Medzi ne patrí transport látok, príjem, inhibícia alebo aktivácia enzýmov.
Celkovo existuje asi 200 biogénnych aminokyselín, ale iba 20 z nich môžu byť proteínové monoméry. Ľahko sa rozpúšťajú vo vode, majú kryštalickú štruktúru a mnohé z nich sú sladkej chuti.
Z chemického hľadiska sú AA molekuly, ktoré nevyhnutne obsahujú dve funkčné skupiny: -COOH a -NH2. Pomocou týchto skupín tvoria aminokyseliny reťazce, ktoré sa navzájom spájajú peptidovou väzbou.
Každá z 20 proteínogénnych aminokyselín má svoj vlastný radikál, podľa toho aký Chemické vlastnosti. Podľa zloženia takýchto radikálov sú všetky AA zaradené do niekoľkých skupín.
- Nepolárne: izoleucín, glycín, leucín, valín, prolín, alanín.
- Polárne a nenabité: treonín, metionín, cysteín, serín, glutamín, asparagín.
- Aromatické: tyrozín, fenylalanín, tryptofán.
- Polárne a negatívne nabité: glutamát, aspartát.
- Polárne a kladne nabité: arginín, histidín, lyzín.
Akákoľvek úroveň organizácie proteínovej štruktúry (primárna, sekundárna, terciárna, kvartérna) je založená na polypeptidovom reťazci pozostávajúcom z AA. Rozdiel je len v tom, ako sa táto postupnosť vytvára v priestore a pomocou akých chemických väzieb sa takáto konformácia udržiava.
Primárna štruktúra proteínu
Akýkoľvek proteín sa tvorí na ribozómoch - nemembránových bunkových organelách, ktoré sa podieľajú na syntéze polypeptidového reťazca. Aminokyseliny sú tu navzájom spojené pomocou silnej peptidovej väzby, čím sa vytvorí primárna štruktúra. Takáto primárna štruktúra proteínu je však extrémne odlišná od kvartérnej, takže je potrebné ďalšie dozrievanie molekuly.
Proteíny ako elastín, históny, glutatión už s takouto jednoduchou štruktúrou sú schopné vykonávať svoje funkcie v tele. Pre veľkú väčšinu proteínov je ďalším krokom vytvorenie zložitejšej sekundárnej konformácie.

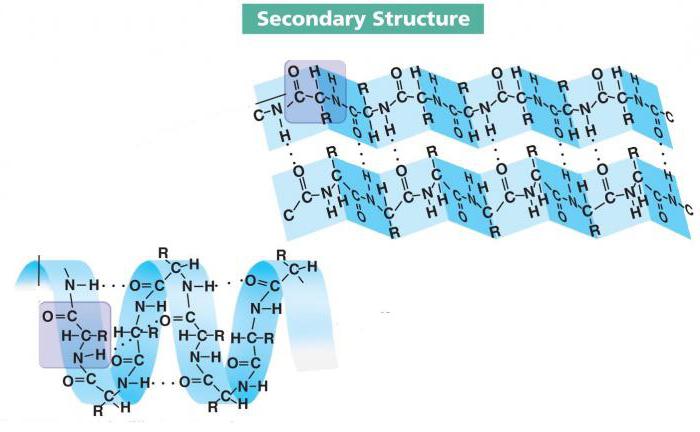
Sekundárna štruktúra proteínu
Tvorba peptidových väzieb je prvým krokom pri dozrievaní väčšiny proteínov. Aby mohli vykonávať svoje funkcie, ich lokálna konformácia musí prejsť určitými zmenami. Dosahuje sa to pomocou vodíkových väzieb – krehkých, no zároveň početných spojení medzi zásaditými a kyslými centrami molekúl aminokyselín.
Takto vzniká sekundárna štruktúra proteínu, ktorá sa od kvartérnej líši jednoduchosťou konfigurácie a lokálnou konformáciou. To znamená, že nie celý reťazec podlieha transformácii. Vodíkové väzby môžu vznikať na viacerých miestach rôznej vzdialenosti od seba a ich tvar závisí aj od typu aminokyselín a spôsobu zostavovania.
Lysozým a pepsín sú zástupcami proteínov, ktoré majú sekundárnu štruktúru. Pepsín sa podieľa na procesoch trávenia a lyzozým plní v tele ochrannú funkciu, ničí bunkové steny baktérií.
Vlastnosti sekundárnej štruktúry
Lokálne konformácie peptidového reťazca sa môžu navzájom líšiť. Preštudovalo sa už niekoľko desiatok a tri z nich sú najbežnejšie. Medzi nimi sú alfa helix, beta vrstvy a beta turn.
- Alfa helix je jednou z najbežnejších sekundárnych štruktúrnych konformácií väčšiny proteínov. Ide o pevný prútový rám so zdvihom 0,54 nm. Radikály aminokyselín sú nasmerované smerom von.
Najbežnejšie sú pravotočivé špirály a niekedy možno nájsť aj ľavákov. Funkciu tvarovania vykonávajú vodíkové väzby, ktoré stabilizujú kučery. Reťazec, ktorý tvorí alfa helix, obsahuje veľmi málo prolínu a polárne nabitých aminokyselín.
- Beta turn je izolovaný v samostatnej konformácii, aj keď to možno nazvať súčasťou beta listu. Podstatou je ohyb peptidového reťazca, ktorý je podporovaný vodíkovými väzbami. Zvyčajne samotné miesto ohybu pozostáva zo 4-5 aminokyselín, medzi ktorými je povinná prítomnosť prolínu. Tento AK má ako jediný pevnú a krátku kostru, ktorá vám umožňuje formovať samotnú zákrutu.
- Beta vrstva je reťazec aminokyselín, ktorý tvorí niekoľko záhybov a stabilizuje ich vodíkovými väzbami. Táto konformácia je veľmi podobná listu papiera zloženému do akordeónu. Najčastejšie majú túto formu agresívne proteíny, ale existuje veľa výnimiek.
Existujú paralelné a antiparalelné beta vrstvy. V prvom prípade sa C- a N- konce na ohyboch a na koncoch reťaze zhodujú, ale v druhom prípade nie.
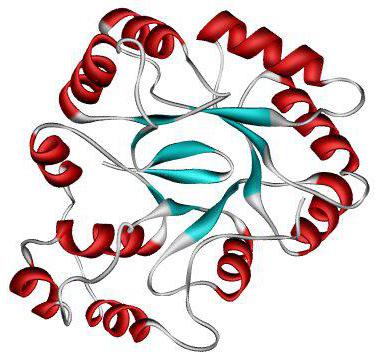
Terciárna štruktúra
Ďalšie balenie proteínu vedie k vytvoreniu terciárnej štruktúry. Táto konformácia je stabilizovaná pomocou vodíkových, disulfidových, hydrofóbnych a iónových väzieb. Ich veľký počet umožňuje sekundárnu štruktúru skrútiť do zložitejšieho tvaru a stabilizovať.
Sú oddelené globulárnymi a globulárnymi peptidmi Molekula globulárnych peptidov je guľovitá štruktúra. Príklady: albumín, globulín, históny v terciárnej štruktúre.
Vytvárajú sa silné pramene, ktorých dĺžka presahuje ich šírku. Takéto proteíny najčastejšie vykonávajú štrukturálne a tvarovacie funkcie. Ide napríklad o fibroín, keratín, kolagén, elastín.
Štruktúra proteínov v kvartérnej štruktúre molekuly
Ak sa niekoľko guľôčok spojí do jedného komplexu, vznikne takzvaná kvartérna štruktúra. Táto konformácia nie je charakteristická pre všetky peptidy a vytvára sa, keď je potrebné vykonávať dôležité a špecifické funkcie.
Každá globula v kompozícii je samostatná doména alebo protomér. Súhrnne sa molekuly nazývajú oligomér.
Typicky má takýto proteín niekoľko stabilných konformácií, ktoré sa neustále nahrádzajú, či už v závislosti od vplyvu niektorých vonkajších faktorov, alebo keď je potrebné vykonávať rôzne funkcie.
Dôležitým rozdielom medzi terciárnou a kvartérnou štruktúrou proteínu sú medzimolekulové väzby, ktoré sú zodpovedné za spojenie niekoľkých guľôčok. V strede celej molekuly sa často nachádza kovový ión, ktorý priamo ovplyvňuje tvorbu medzimolekulových väzieb.
Ďalšie proteínové štruktúry
Nie vždy reťazec aminokyselín postačuje na vykonávanie funkcií proteínu. Vo väčšine prípadov sú na takéto molekuly naviazané iné látky organickej a anorganickej povahy. Keďže táto vlastnosť je charakteristická pre veľkú väčšinu enzýmov, zloženie komplexných proteínov sa zvyčajne delí na tri časti:
- Apoenzým je proteínová časť molekuly, čo je sekvencia aminokyselín.
- Koenzým nie je bielkovina, ale organická súčasť. Môže zahŕňať rôzne typy lipidov, sacharidov alebo dokonca nukleových kyselín. Patria sem zástupcovia biologicky aktívnych zlúčenín, medzi ktorými sú vitamíny.
- Kofaktor - anorganická časť, reprezentovaná v drvivej väčšine prípadov iónmi kovov.
Štruktúra proteínov v kvartérnej štruktúre molekuly si vyžaduje účasť niekoľkých molekúl rôzneho pôvodu, takže veľa enzýmov má tri zložky naraz. Príkladom je fosfokináza, enzým, ktorý zabezpečuje prenos fosfátovej skupiny z molekuly ATP.
Kde sa tvorí kvartérna štruktúra molekuly proteínu?
Polypeptidový reťazec sa začína syntetizovať na ribozómoch bunky, ale k ďalšiemu dozrievaniu proteínu dochádza už v iných organelách. Novovytvorená molekula sa musí dostať do transportného systému, ktorý pozostáva z jadrovej membrány, ER, Golgiho aparátu a lyzozómov.
Komplikácia priestorovej štruktúry proteínu nastáva v endoplazmatickom retikule, kde nielen rôzne druhy väzby (vodíková, disulfidová, hydrofóbna, intermolekulárna, iónová), ale spája sa aj koenzým a kofaktor. Takto vzniká kvartérna štruktúra proteínu.
Keď je molekula úplne pripravená na prácu, vstupuje buď do cytoplazmy bunky alebo do Golgiho aparátu. V druhom prípade sú tieto peptidy zabalené do lyzozómov a transportované do iných kompartmentov bunky.
Príklady oligomérnych proteínov
Kvartérna štruktúra je štruktúra bielkovín, ktorá je navrhnutá tak, aby prispievala k plneniu životných funkcií v živom organizme. Komplexná konformácia organických molekúl umožňuje predovšetkým ovplyvňovať prácu mnohých metabolických procesov (enzýmov).
Biologicky dôležité bielkoviny sú hemoglobín, chlorofyl a hemocyanín. Základom týchto molekúl je porfyrínový kruh, v strede ktorého je kovový ión.
Hemoglobín
Kvartérna štruktúra molekuly hemoglobínového proteínu pozostáva zo 4 globúl spojených medzimolekulovými väzbami. V strede je porfín so železnatým iónom. Proteín je transportovaný v cytoplazme erytrocytov, kde zaberajú asi 80 % celkového objemu cytoplazmy.
Základom molekuly je hém, ktorý má anorganickejšiu povahu a je sfarbený do červena. Je tiež primárnym produktom rozkladu hemoglobínu v pečeni.
Všetci vieme, že hemoglobín plní dôležitú transportnú funkciu – prenos kyslíka a oxidu uhličitého v ľudskom tele. Komplexná konformácia molekuly proteínu vytvára špeciálne aktívne centrá, ktoré sú schopné viazať zodpovedajúce plyny na hemoglobín.
Pri tvorbe komplexu proteín-plyn vzniká takzvaný oxyhemoglobín a karbohemoglobín. Existuje však aj iný typ takýchto asociácií, ktorý je celkom stabilný: karboxyhemoglobín. Ide o komplex bielkovín a oxidu uhoľnatého, ktorého stabilita vysvetľuje záchvaty udusenia s nadmernou toxicitou.

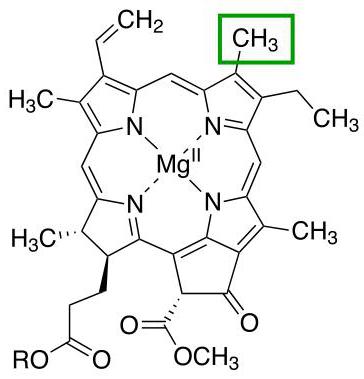
Chlorofyl
Ďalší zástupca proteínov s kvartérnou štruktúrou, ktorých doménové väzby sú už podporované horčíkovým iónom. Hlavnou funkciou celej molekuly je účasť na procesoch fotosyntézy v rastlinách.
Existujú rôzne typy chlorofylov, ktoré sa navzájom líšia radikálmi porfyrínového kruhu. Každá z týchto odrôd je označená samostatným písmenom latinskej abecedy. Napríklad suchozemské rastliny sa vyznačujú prítomnosťou chlorofylu a alebo chlorofylu b a iné typy tohto proteínu sa nachádzajú v riasach.
Hemocyanín
Táto molekula je analógom hemoglobínu u mnohých nižších živočíchov (článkonožcov, mäkkýšov atď.). Hlavným rozdielom v štruktúre proteínu s kvartérnou molekulárnou štruktúrou je prítomnosť iónu zinku namiesto iónu železa. Hemocyanín má modrastú farbu.
Niekedy sa ľudia čudujú, čo by sa stalo, keby sme ľudský hemoglobín nahradili hemokyanínom. V tomto prípade je narušený obvyklý obsah látok v krvi, najmä aminokyselín. Hemocyanín je tiež nestabilný pri vytváraní komplexu s oxidom uhličitým, takže „modrá krv“ by mala tendenciu vytvárať krvné zrazeniny.
Pred viac ako 4 miliardami rokov na Zemi z malých anorganických molekúl nepochopiteľným spôsobom vznikli proteíny, ktoré sa stali stavebnými kameňmi živých organizmov. Všetky živé veci vďačia za svoju nekonečnú rozmanitosť práve jedinečným molekulám bielkovín a iné formy života vo vesmíre veda stále nepozná.
Proteíny alebo proteíny (z gréckeho "protos" - "prvé") sú prírodné organické zlúčeniny, ktoré zabezpečujú všetky životné procesy akéhokoľvek organizmu. Šošovka oka a pavučina, pancier korytnačky a toxické látky huby... Pomocou bielkovín trávime potravu a bojujeme s chorobami. Vďaka špeciálnym proteínom žiaria v noci svetlušky a v hlbinách oceánu sa medúzy trblietajú tajomným svetlom.
V živej bunke je mnohonásobne viac molekúl bielkovín ako všetky ostatné (okrem vody, samozrejme!). Vedci zistili, že vo väčšine organizmov tvoria proteíny viac ako polovicu ich suchej hmoty. A rozmanitosť typov proteínov je veľmi veľká – v jednej bunke takého malého organizmu, akým je baktéria Escherichia soy“ (pozri dodatočnú esej „Predmetom štúdia sú prokaryoty“), je asi 3 000 rôznych proteínov.
Proteín prvýkrát izoloval (vo forme lepku) v roku 1728 Talian Jacopo Bartolomeo Beccari (1682-1766) z pšeničnej múky. Táto udalosť sa považuje za zrod proteínovej chémie. Odvtedy, počas takmer troch storočí, sa z prírodných zdrojov získali tisíce rôznych bielkovín a skúmali sa ich vlastnosti.
BIOLOGICKÉ "KORÁLKY"
Molekula proteínu je veľmi dlhá. Chemici nazývajú takéto molekuly polymérne (z gréckeho "poly" - "veľa" a "meros" - "časť", "podiel"). V skutočnosti dlhá molekula polyméru pozostáva z mnohých malých molekúl spojených navzájom. Takto sa navliekajú korálky na niť v náhrdelníku. V polyméroch zohrávajú úlohu vlákna chemické väzby medzi guľôčkami-molekulami.
Tajomstvo proteínov je skryté vo vlastnostiach týchto rovnakých guľôčok. Väčšina polymérov nemá v priestore stabilný tvar, stávajú sa ako tie isté guľôčky, ktoré nemôžu mať priestorovú štruktúru: ak si ich zavesíte na krk, budú mať tvar prsteňa alebo oválu, ak ich vložíte do škatuľky. , skrútia sa do klbka neurčitého tvaru. A teraz si predstavme, že niektoré korálky sa môžu navzájom „zlepiť“. Napríklad červené priťahujú žlté. Potom celá retiazka nadobudne určitú formu, vďaka svojej existencii „zlepením“ žltých a červených guľôčok
Niečo podobné sa deje v bielkovinách. Samostatné malé molekuly, ktoré tvoria proteín, majú schopnosť „držať sa spolu“, pretože medzi nimi pôsobia príťažlivé sily. Výsledkom je, že akýkoľvek proteínový reťazec má priestorovú štruktúru charakteristickú len pre neho. Je to ona, ktorá určuje úžasné vlastnosti bielkovín. Bez takejto štruktúry by nemohli vykonávať funkcie, ktoré vykonávajú v živej bunke.
Pri dlhšom vare bielkovín v prítomnosti silných kyselín alebo zásad sa proteínové reťazce rozpadajú na ich základné molekuly,
nazývané aminokyseliny. Aminokyseliny sú „perličky“, ktoré tvoria proteín a sú pomerne jednoduché.
AKO SA NAVRHUJE AMINOKYSELINA
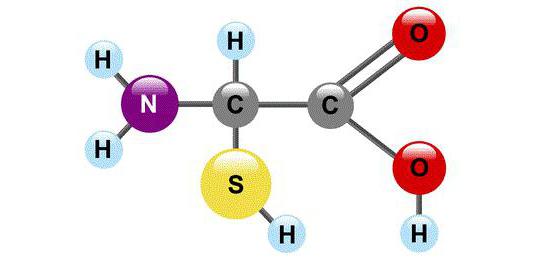
Každá molekula aminokyseliny má atóm uhlíka pripojený k štyrom substituentom. Jedným z nich je atóm vodíka, druhým je karboxylová skupina -COOH. Ľahko „uvoľňuje“ vodíkový ión H +, vďaka čomu je slovo „kyselina“ prítomné v názve aminokyselín. Tretím substituentom je aminoskupina - NH 2 a napokon štvrtým substituentom je skupina atómov, ktorá v všeobecný prípad označovať R. Všetky aminokyseliny majú rôzne R-skupiny a každá z nich hrá svoju vlastnú, veľmi dôležitú úlohu.
Vlastnosti „guľôčok“, ktoré odlišujú jednu aminokyselinu od druhej, sú skryté v R-skupinách (nazývajú sa aj vedľajšie reťazce). Pokiaľ ide o skupinu COOH, organickí chemici s ňou zaobchádzajú s veľkým rešpektom: všetky ostatné atómy uhlíka v molekule sú označené v závislosti od stupňa ich vzdialenosti od karboxylovej skupiny. Najbližší atóm k nemu sa nazýva a-atóm, druhý sa nazýva b-atóm, ďalší je y-atóm atď. Atóm uhlíka v aminokyselinách, ktorý je najbližšie ku karboxylovej skupine, t.j. atóm je tiež spojený s aminoskupinou, takže prirodzené aminokyseliny, ktoré tvoria proteín, sa nazývajú a-aminokyseliny.
V prírode existujú aj aminokyseliny, v ktorých je NH^-skupina naviazaná na atómy uhlíka vzdialenejšie od karboxylovej skupiny. Príroda si však na stavbu bielkovín vybrala a-aminokyseliny. Je to spôsobené predovšetkým tým, že iba a-aminokyseliny spojené do dlhých reťazcov sú schopné poskytnúť dostatočnú pevnosť a stabilitu štruktúry veľkých molekúl bielkovín.
Počet a-aminokyselín, ktoré sa líšia v R-skupine, je veľký. Ale častejšie ako iné sa v bielkovinách nachádza len 20 rôznych aminokyselín. Možno ich považovať za abecedu „jazyka“ molekuly proteínu. Chemici nazývajú tieto hlavné aminokyseliny štandardné, zásadité alebo normálne. Bežne sa hlavné aminokyseliny delia do štyroch tried.
Prvý zahŕňa aminokyseliny s nepolárnymi bočnými reťazcami. V druhej - aminokyseliny obsahujúce polárnu skupinu. Ďalšie dve sú aminokyseliny s bočnými reťazcami, ktoré môžu byť nabité pozitívne (spájajú sa do tretej triedy) alebo negatívne (štvrté). Napríklad disociácia karboxylovej skupiny poskytuje anión - COO- a protonácia atómu dusíka - katión, napríklad - NH3+. Postranné reťazce kyseliny asparágovej a kyseliny glutámovej majú ešte jednu karboxylovú skupinu COOH, ktorá sa pri hodnotách pH charakteristických pre živú bunku (pH = 7) rozpadá s vodíkovým iónom (H+) a získava záporný náboj. Bočné reťazce aminokyselín lyzínu, arginínu a histidínu sú kladne nabité, pretože majú atómy dusíka, ktoré naopak môžu pripojiť vodíkový ión.
Každá a-aminokyselina (okrem glycínu) môže v závislosti od vzájomného usporiadania štyroch substituentov existovať v dvoch formách. Líšia sa od seba, ako predmet od svojho zrkadlového obrazu alebo ako pravá ruka od ľavej ruky. Takéto zlúčeniny sa nazývajú chorál (z gréckeho "hir" - "ruka"). Chirálne molekuly objavil v roku 1848 veľký francúzsky vedec Louis Pasteur. Dva typy optických izomérov organických molekúl dostali názvy D-forma (z latinského dexter - "pravý") a Z-forma (z latinského laevus - "ľavý"). Mimochodom, jedným z názvov ďalších chirálnych molekúl - glukózy a fruktózy - je dextróza a levulóza. Je pozoruhodné, že v zložení proteínov sú zahrnuté iba Z-aminokyseliny a všetok proteínový život na Zemi je "zanechaný".
Pre normálne fungovanie potrebuje telo kompletnú sadu 20 základných a-Z-aminokyselín. Niektoré z nich však môžu byť syntetizované v bunkách samotného organizmu, zatiaľ čo iné musia pochádzať v hotovej forme z potravinových produktov. V prvom prípade sa aminokyseliny nazývajú neesenciálne a v druhom - nevyhnutné. Súbor posledne menovaných je odlišný pre rôzne organizmy. Napríklad pre bieleho potkana je nevyhnutných 10 aminokyselín a pre baktérie mliečneho kvasenia 16. Rastliny dokážu nezávisle syntetizovať širokú škálu aminokyselín, vytvárať tie, ktoré sa nenachádzajú v bielkovinách.
Pre pohodlie je 20 hlavných aminokyselín symbolizovaných pomocou jedného alebo prvých troch písmen ruského alebo anglického názvu aminokyseliny, napríklad alanín - Ala alebo A, glycín - Gly alebo G.
ČO JE PEPTID
Molekula polymérneho proteínu vzniká spojením do dlhého reťazca guľôčok aminokyselín. Sú navlečené na vlákne chemických väzieb v dôsledku amino a karboxylových skupín prítomných vo všetkých aminokyselinách pripojených k atómu uhlíka a.
Zlúčeniny vytvorené ako výsledok takejto reakcie sa nazývajú peptidy; (-CO- NH - skupina v nich je peptidová skupina a väzba medzi atómami uhlíka a dusíka je peptidová väzba (nazýva sa aj amidová väzba). Spojením aminokyselín cez peptidové väzby získate peptidy pozostávajúce z zvyškov veľmi mnohých aminokyselín.Takéto zlúčeniny sa nazývajú polypeptidy.Polyptidovú štruktúru molekuly proteínu dokázal v roku 1902 nemecký chemik Emil Hermann Fischer.
Na koncoch aminokyselinového reťazca sú voľné aminoskupiny a karboxylové skupiny; tieto konce reťazca sa nazývajú N- a C-konce. Aminokyselinové zvyšky v polypeptidovom reťazci sú zvyčajne číslované od N-konca.
Celkový počet aminokyselinových zvyškov v molekule proteínu sa mení vo veľmi širokom rozmedzí. Ľudský inzulín teda pozostáva z 51 aminokyselinových zvyškov a lyzozým z materského mlieka pozostáva zo 130. V ľudskom hemoglobíne sú 4 aminokyselinové reťazce, z ktorých každý je vytvorený z približne 140 aminokyselín. Existujú proteíny, ktoré majú takmer 3 tisíc aminokyselinových zvyškov v jednom reťazci.
Molekulové hmotnosti proteínov sa pohybujú od približne 11 000 pre malé proteíny pozostávajúce zo 100 aminokyselinových zvyškov do 1 milióna alebo viac pre proteíny s veľmi dlhými polypeptidovými reťazcami alebo pre proteíny pozostávajúce z niekoľkých polypeptidových reťazcov.
Vynára sa otázka: ako môže byť celá obrovská rozmanitosť proteínov s rôznymi funkciami a vlastnosťami vytvorená len z 20 molekúl? A kľúč k tomuto tajomstvu prírody je jednoduchý – každý proteín má svoje vlastné jedinečné zloženie aminokyselín a jedinečné poradie kombinácie aminokyselín, ktoré sa nazýva primárna štruktúra proteínu.
ŠPIRÁLY A VRSTVY
Začiatkom 50. rokov. 20. storočie Americkí chemici Linus Carl Pauling (1901-1994), ktorý získal Nobelovu cenu za výskum povahy chemickej väzby, a Robert Corey (1897-1971) navrhli, že niektoré časti reťazca aminokyselín v proteínoch sú skrútené do špirála. Vďaka zdokonaleniu experimentálnych metód (štruktúra proteínov sa študuje pomocou röntgenového žiarenia) sa po niekoľkých rokoch potvrdila táto geniálna domnienka.
Polypeptidové reťazce totiž veľmi často tvoria pravotočivú špirálu. Toto je prvá, najnižšia úroveň priestorovej organizácie proteínových reťazcov. Tu začínajú hrať úlohu slabé interakcie „guľôčok“ aminokyselín: môže sa vytvoriť skupina C \u003d 0 a skupina N - H z rôznych peptidových väzieb. medzi sebou vodíkovú väzbu. Ukázalo sa, že v špirále objavenej Paulingom a Coreym sa takáto väzba vytvorí medzi skupinou C = 0 každej i-tej aminokyseliny a skupinou N - H (i + 4) aminokyseliny, t.j. sú vzájomne prepojené zvyšky vzdialené od seba štyri "korálky". Tieto vodíkové väzby stabilizujú takúto špirálu ako celok. Dostala meno a.-špirála.
Neskôr sa ukázalo, že a-helix nie je jediný spôsob, ako zložiť reťazce aminokyselín. Okrem špirál tvoria aj vrstvy. Vďaka rovnakým vodíkovým väzbám medzi skupinami C = 0 a N - H sa môže naraz „zlepiť“ niekoľko rôznych fragmentov jedného polypeptidového reťazca. V dôsledku toho sa získa celá vrstva - nazývala sa ^-vrstva.
Vo väčšine proteínov sú a-helixy a p-vrstvy rozptýlené so všetkými druhmi záhybov a reťazových fragmentov bez akejkoľvek definitívnej štruktúry. Pri priestorovej štruktúre jednotlivých úsekov proteínu sa hovorí o sekundárnej štruktúre molekuly proteínu.
PROTEÍN VO VESMÍRE
Na získanie úplného „portrétu“ molekuly proteínu nestačí znalosť primárnej a sekundárnej štruktúry. Tieto informácie ešte nedávajú predstavu ani o objeme, ani o tvare molekuly, tým menej o umiestnení častí reťazca vo vzťahu k sebe navzájom. Ale všetky špirály a vrstvy sú nejakým spôsobom umiestnené v priestore. Všeobecná priestorová štruktúra polypeptidového reťazca sa nazýva terciárna štruktúra proteínu.
Prvé priestorové modely proteínových molekúl - myoglobínu a hemoglobínu - boli postavené koncom 50. rokov. 20. storočie Anglickí biochemici John Coudery Kendrew (nar. 1917) a Max Ferdinand Perutz (nar. 1914). Použili pri tom údaje z experimentov s röntgenovými lúčmi. Za výskum v oblasti štruktúry bielkovín dostali Kendrew a Perutz v roku 1962 Nobelovu cenu. A na konci storočia bola určená terciárna štruktúra už niekoľko tisíc bielkovín.
Keď sa vytvorí terciárna štruktúra proteínu, R-skupiny, postranné reťazce aminokyselín, konečne vykazujú aktivitu. Vďaka nim sa väčšina „guľôčok“-aminokyselín „zlepí“ medzi sebou, čím reťazec získa určitý tvar v priestore.
V živom organizme sú bielkoviny vždy vo vodnom prostredí. A najväčší počet základných aminokyselín – osem – obsahuje nepolárne R-skupiny. Samozrejme, proteín má tendenciu spoľahlivo skrývať nepolárne bočné reťazce vo vnútri svojej molekuly, aby obmedzil ich kontakt s vodou. Vedci tomu hovoria vznik hydrofóbnych interakcií (pozri článok „Najmenšia jednotka života“).
V dôsledku hydrofóbnych interakcií má celý polypeptidový reťazec určitý tvar v priestore, t. j. tvorí terciárnu štruktúru.
V molekule proteínu pôsobia aj iné sily. Niektoré z bočných reťazcov hlavných aminokyselín sú nabité záporne a niektoré kladne. Keďže záporné náboje sú priťahované k pozitívnym, zodpovedajúce „perličky“ sa „držia spolu“. Elektrostatické interakcie, alebo, ako sa im hovorí, soľné mostíky, sú ďalšou dôležitou silou, ktorá stabilizuje terciárnu štruktúru.
Sedem základných aminokyselín má polárne bočné reťazce. Môžu medzi nimi vznikať vodíkové väzby, ktoré tiež zohrávajú významnú úlohu pri udržiavaní priestorovej štruktúry proteínu.
Medzi dvoma aminokyselinovými zvyškami sa niekedy tvoria cysteínové zvyšky Kovalentné väzby(- S -S-), ktoré veľmi pevne fixujú umiestnenie rôznych častí proteínového reťazca voči sebe navzájom. Takéto väzby sa nazývajú disulfidové mostíky. Ide o najpočetnejšie interakcie v proteínoch (v niektorých prípadoch vo všeobecnosti chýbajú), ale pokiaľ ide o silu, nemajú obdobu.
NAJVYŠŠIA ÚROVEŇ PRIESTOROVEJ ORGANIZÁCIE PROTEÍNOV
Proteínová molekula nemusí pozostávať z jedného, ale z niekoľkých polypeptidových reťazcov. Každý takýto reťazec je nezávislou priestorovou štruktúrou – podjednotkou. Napríklad hemoglobínový proteín pozostáva zo štyroch podjednotiek, ktoré tvoria jedinú molekulu umiestnenú vo vrcholoch takmer pravidelného štvorstenu. Podjednotky sa k sebe „lepia“ v dôsledku rovnakých síl, ktoré stabilizujú terciárnu štruktúru. Ide o hydrofóbne interakcie, soľné mostíky a vodíkové väzby.
Ak sa proteín skladá z niekoľkých podjednotiek, hovorí sa, že má kvartérnu štruktúru. Takáto štruktúra je najvyššej úrovni organizácia molekuly proteínu. Na rozdiel od prvé triúrovniach, nie všetky proteíny majú kvartérnu štruktúru. Približne polovica dnes známych bielkovín ho nemá.
PREČO SA PROTEÍNY BOJA TEPLA
Väzby, ktoré podporujú priestorovú štruktúru proteínu, sa celkom ľahko zničia. Z detstva vieme, že pri varení vajec sa priehľadný bielok zmení na elastickú bielu hmotu a mlieko pri vykysnutí hustne. Deje sa tak v dôsledku deštrukcie priestorovej štruktúry albumínových proteínov vo vaječnom bielku a kazeínu (ogglat. caseus – „syr“) v mlieku. Tento proces sa nazýva denaturácia. V prvom prípade je to spôsobené zahrievaním a v druhom výrazným zvýšením kyslosti (v dôsledku životnej aktivity baktérií žijúcich v mlieku). Počas denaturácie stráca proteín svoju schopnosť vykonávať svoje prirodzené funkcie v tele (odtiaľ názov procesu: z latinčiny denaturare - „zbaviť prirodzených vlastností“). Denaturované bielkoviny telo ľahšie vstrebáva, preto je jedným z cieľov tepelnej úpravy potravinárskych výrobkov denaturácia bielkovín.
PREČO JE POTREBNÁ PRIESTOROVÁ ŠTRUKTÚRA
V prírode sa takmer nič nedeje náhodou. Ak proteín nadobudol určitý tvar v priestore, musí to slúžiť na dosiahnutie nejakého cieľa. V skutočnosti iba proteín so „správnou“ priestorovou štruktúrou môže mať určité vlastnosti, teda vykonávať v tele tie funkcie, ktoré sú mu predpísané. A robí to pomocou rovnakých R-skupín aminokyselín. Ukazuje sa, že postranné reťazce nielen udržiavajú „správny“ tvar molekuly proteínu v priestore. R-skupiny môžu viazať iné organické a anorganické molekuly, zúčastňujú sa chemických reakcií, pôsobia napríklad ako katalyzátor.
Často je samotná priestorová organizácia polypeptidového reťazca len "potrebná na to, aby sa v určitých bodoch v priestore sústredila množina postranných reťazcov potrebných na vykonávanie určitej funkcie. Možno ani jeden proces v živom organizme neprejde bez účasti bielkoviny.
V ČOM JE TAJOMSTVO ENZÝMOV
Všetky chemické reakcie prebiehajúce v bunke sa vyskytujú v dôsledku špeciálnej triedy proteínov - enzýmov. Sú to katalytické proteíny. Majú svoje vlastné tajomstvo, ktoré im umožňuje pracovať oveľa efektívnejšie ako iné katalyzátory, čím sa zrýchľujú reakcie miliardkrát.
Predpokladajme, že niekoľko priateľov sa nemôže žiadnym spôsobom stretnúť. No len čo jeden z nich pozval priateľov na narodeninovú oslavu, výsledok na seba nenechal dlho čakať: všetci boli v určený čas na rovnakom mieste.
Aby sa stretnutie uskutočnilo, bolo potrebné dotlačiť priateľov, aby kontaktovali. Enzým robí to isté. V jeho molekule sa nachádzajú takzvané väzbové centrá. Obsahujú „pohodlné stoličky“ atraktívne pre určitý typ chemických zlúčenín (a len pre ne!) - R-skupiny, ktoré spájajú niektoré úseky molekúl reagujúcich látok. Napríklad, ak jedna z molekúl má nepolárnu skupinu, vo väzbovom centre sú hydrofóbne bočné reťazce. Ak je v molekule záporný náboj, R-skupina s kladným nábojom naň počká v molekule enzýmu.
Výsledkom je, že obe molekuly činidla sa viažu na enzým a sú vo vzájomnej tesnej blízkosti. Navyše tie skupiny z nich, ktoré by sa mali pripojiť chemická reakcia, orientovaný v priestore spôsobom potrebným pre reakciu. Teraz sa preberajú vedľajšie reťazce enzýmu, ktoré zohrávajú úlohu katalyzátorov. V enzýme je všetko „vymyslené“ tak, že aj R-skupiny-katalyzátory sú umiestnené blízko miesta diania, ktoré sa nazýva aktívne centrum. A po dokončení reakcie enzým „uvoľňuje“ molekuly produktu (pozri článok „Enzýmy sú majstrom všetkých remeselníkov“).
ODKIAĽ IMUNITA POCHÁDZA
Proteíny vykonávajú v tele mnoho funkcií; napríklad chránia bunky pred nežiaducimi prienikmi, chránia ich pred poškodením. Špeciálne proteíny - protilátky majú schopnosť rozpoznať baktérie, vírusy, cudzie molekuly polyméru, ktoré sa dostali do buniek a neutralizovať ich.
U vyšších stavovcov imunitný systém chráni telo pred cudzími časticami. Je navrhnutý tak, že telo, ktoré je napadnuté takýmito „agresormi“ – antigénmi, začne produkovať protilátky. Molekula protilátky je pevne naviazaná na antigén: protilátky, podobne ako enzýmy, majú tiež väzbové centrá. Bočné reťazce aminokyselín sú umiestnené v centrách tak, že antigén, ktorý padol do tejto pasce, už nemôže uniknúť zo „železných labiek“ protilátky. Po naviazaní na protilátku je nepriateľ z tela vypudený.
Do tela môžete vstúpiť malé množstvo určitých molekúl polyméru, ktoré sú súčasťou baktérií alebo vírusov, ktoré spôsobujú infekčné ochorenie.
Zodpovedajúce protilátky sa okamžite objavia v tele. Teraz bude „skutočný“ patogénny mikrób, ktorý vstúpil do krvi alebo lymfy, okamžite napadnutý týmito protilátkami a choroba bude porazená. Tento spôsob boja s infekciou nie je nič iné ako mnohými nemilované očkovanie. Telo vďaka nemu získava imunitu voči infekčným chorobám.
PREČO JE V HEMOGLOBÍNE ŽELEZO
V prírode existujú bielkoviny, ktoré okrem aminokyselín obsahujú ďalšie chemické zložky, ako sú lipidy, cukry, ióny kovov. Zvyčajne tieto zložky zohrávajú dôležitú úlohu pri plnení biologickej funkcie proteínu. Prenos molekúl a iónov z jedného orgánu do druhého sa teda uskutočňuje transportnými proteínmi krvnej plazmy. Proteín hemoglobín (z gréckeho "hema" - "krv" a latinského globus - "guľa", "guľa") obsiahnutý v krvných bunkách - erytrocytoch (z gréckeho "erythros" - "červený" a "kitos" - " bunka"), dodáva kyslík z pľúc do tkanív. V molekule hemoglobínu sa nachádza komplex železitého iónu Fe 24" so zložitou organickou molekulou, nazývanou hem. Hemoglobín pozostáva zo štyroch proteínových podjednotiek a každá z nich obsahuje jeden hém.
Ión železa sa priamo podieľa na väzbe kyslíka v pľúcach. Akonáhle sa k nemu pridá kyslík aspoň v jednej z podjednotiek, samotný ión okamžite mierne zmení svoje umiestnenie v molekule proteínu. Pohyb železa „vyprovokuje“ pohyb celého reťazca aminokyselín tejto podjednotky, čím sa mierne pretvára jeho terciárna štruktúra.
Ďalšia podjednotka, ktorá ešte nepridala kyslík, „cíti“, čo sa stalo jej susedovi. Začína sa meniť aj jeho štruktúra. Výsledkom je, že druhá podjednotka viaže kyslík ľahšie ako prvá. Pridávanie kyslíka do tretej a štvrtej podjednotky prebieha s ešte menšími ťažkosťami. Ako vidíte, podjednotky si navzájom pomáhajú vo svojej práci. Na to potrebuje hemoglobín kvartérnu štruktúru. Oxid uhoľnatý CO (hovorovo oxid uhoľnatý) sa viaže na železo v heme stokrát silnejšie ako kyslík. Oxid uhoľnatý je pre človeka smrteľný, pretože zbavuje hemoglobín schopnosti viazať kyslík.
A VIAC PROTEÍNOV...
Slúžia ako živiny. Semená mnohých rastlín (pšenica, kukurica, ryža atď.) obsahujú potravinové bielkoviny. Zahŕňajú aj albumín - hlavnú zložku bielok a kazeín, hlavná bielkovina v mlieku. Pri trávení bielkovinovej potravy v ľudskom tele dochádza k hydrolýze peptidových väzieb. Proteíny sa „rozkladajú“ na jednotlivé aminokyseliny, z ktorých si telo následne „buduje“ nové peptidy alebo ich využíva na energiu. Odtiaľ názov:
Grécke slovo „peptos“ znamená „strávený“. Zaujímavé je, že hydrolýzu peptidovej väzby riadia aj proteíny – enzýmy.
Podieľať sa na regulácii bunkovej a fyziologickej aktivity. Tieto proteíny zahŕňajú veľa hormónov (z gréckeho „gormao“ - „indukujem“), ako je inzulín, ktorý reguluje metabolizmus glukózy, a rastový hormón.
Dávajú telu schopnosť meniť tvar a pohybovať sa. Sú za to zodpovedné bielkoviny aktín a myozín, z ktorých sa stavajú svaly.
Vykonávajú podporné a ochranné funkcie, upevňujú biologické štruktúry a dodávajú im silu. Koža je takmer čistý kolagénový proteín, zatiaľ čo vlasy, nechty a perie sú tvorené tvrdým, nerozpustným proteínom keratínom.
ČO JE NAPÍSANÉ V GÉNOCH
Sekvencia aminokyselín v bielkovinách je kódovaná génmi, ktoré sa ukladajú a dedia pomocou molekúl DNA (viď články "Držiteľ dedičnej informácie. DNA" a "Génová expresia"). Priestorová štruktúra proteínu je určená presne poradím, v ktorom sú aminokyseliny usporiadané. Ukazuje sa, že nielen primárne, ale aj sekundárne, terciárne a kvartérne štruktúry bielkovín tvoria obsah dedičnej informácie. V dôsledku toho sú funkcie vykonávané proteínmi geneticky naprogramované. Obrovský zoznam týchto funkcií umožňuje, aby sa proteíny právom nazývali hlavnými molekulami života. Preto sú informácie o bielkovinách tým neoceniteľným pokladom, ktorý sa v prírode prenáša z generácie na generáciu.
Ľudský záujem o tieto organické zlúčeniny sa každým rokom zvyšuje. Dnes už vedci rozlúštili štruktúru mnohých molekúl bielkovín. Zisťujú funkcie rôznych bielkovín, snažia sa určiť vzťah medzi funkciami a štruktúrou. Stanovenie podobností a rozdielov v proteínoch, ktoré vykonávajú podobné funkcie v rôznych živých organizmoch, vám umožňuje preniknúť hlbšie do tajomstiev evolúcie.
AMINOKYSELINY - UKAZOVATELE VEKU
D - a L -formy aminokyselín majú schopnosť veľmi pomaly sa navzájom premieňať. Počas určitého (veľmi dlhého) časového obdobia sa čistá D- alebo I-forma môže stať zmesou rovnakých množstiev oboch foriem. Takáto zmes sa nazýva raiemagom a samotný proces sa nazýva raie-mizaiiya. Rýchlosť racemizácie závisí od teploty a typu aminokyseliny. Táto vlastnosť sa môže použiť na určenie veku fosílnych zvyškov organizmov a v prípade potreby aj živých bytostí. Napríklad v bielkovine dentínu (dentín je kostné tkanivo zubov) sa kyselina 1-ac-partová spontánne reemizuje rýchlosťou 0,1 % za rok. U detí v období tvorby zubov obsahuje dentín iba kyselinu 1-asparágovú. Zo zuba sa izoluje dentín a zisťuje sa v ňom obsah 0-formy. Výsledky testov sú celkom presné. Takže u 97-ročnej ženy, ktorej vek bol zdokumentovaný, test ukázal vek 99 rokov. Údaje štúdií uskutočnených na fosílnych pozostatkoch pravekých zvierat – slonov, delfínov, medveďov – sú v dobrej zhode s výsledkami datovania získanými rádionuklidovou metódou.
PREČO ZÍSKAL SENGER NOBELOVÉ CENY
Pri hydrolýze bielkovín na aminokyseliny (deštrukcia peptidovej väzby vodou) sa stráca informácia o postupnosti ich spojenia. Preto sa dlho verilo, že určenie primárnej štruktúry proteínu je úplne beznádejná úloha. Ale v 50-tych rokoch. 20. storočie Anglický biochemik Frederick Sanger (nar. 1918) dokázal rozlúštiť poradie aminokyselín v polypeptidových reťazcoch inzulínového hormónu. Za túto prácu, ktorá trvala niekoľko rokov, bola Sangerovi v roku 1958 udelená Nobelova cena za chémiu (o dvadsať rokov neskôr spolu s W. Gilbertom druhú cenu za prínos k vytvoreniu primárnej štruktúry DNA) .
Princípy na určenie sekvencie aminokyselín, ktoré prvýkrát sformuloval Sanger, sa používajú dodnes, avšak so všetkými možnými obmenami a vylepšeniami. Postup stanovenia primárnej štruktúry proteínu je zložitý a viacstupňový: je v ňom asi tucet rôznych štádií. Najprv sa bielkovina rozloží na jednotlivé aminokyseliny a určí sa ich druh a množstvo v danej látke. V ďalšej fáze už nie je dlhá molekula proteínu úplne rozdelená, ale na fragmenty. Potom sa v týchto fragmentoch určí poradie spojenia aminokyselín, pričom sa postupne oddelia jedna po druhej. Rozdelenie proteínu na fragmenty sa uskutočňuje niekoľkými spôsobmi, takže v rôznych fragmentoch existujú prekrývajúce sa časti. Po zistení poradia aminokyselín vo všetkých fragmentoch získajú úplné informácie o tom, ako sa aminokyseliny nachádzajú v proteíne. Do konca XX storočia. boli vytvorené špeciálne zariadenia, ktoré automaticky určujú poradie aminokyselín v molekule proteínu - sekvenátory (z anglickej sekvencie - „sekvencia“).
MLIEKO A MLIEČNE VÝROBKY
Mlieko je koloidný roztok tuku vo vode. Pod mikroskopom je jasne vidieť, že je heterogénny: tukové guľôčky plávajú v bezfarebnom roztoku (séru).
Kravské mlieko zvyčajne obsahuje 3 až 6 % tuku (väčšinou estery glycerolu a nasýtené karboxylové kyseliny- palmitová, stearová), asi 3 % bielkovín, ďalej sacharidy, organické kyseliny, vitamíny a minerály.
Kazeínový proteín v mlieku je prítomný vo viazanej forme - fosfátové skupiny kovalentne naviazané na aminokyselinu serín tvoria soli s iónmi vápnika. Pri okyslení mlieka sa tieto soli zničia a kazeín sa uvoľní vo forme bielej tvarohovej hmoty. V ľudskom žalúdku dochádza pod pôsobením špeciálnych enzýmov k procesu nazývanému „zrážanie kazeínu“. Zrazený kazeín sa zráža a pomalšie sa vylučuje z tela, a preto sa úplnejšie vstrebáva. Kazeín je vysoko výživný:
Obsahuje takmer všetky aminokyseliny, ktoré človek potrebuje na stavbu vlastných bielkovín. AT čistej forme je to biely prášok bez chuti, nerozpustný vo vode. Okrem neho obsahuje mlieko aj iné bielkoviny, napríklad laktalbumín. Varením sa táto bielkovina mení na nerozpustnú formu a na povrchu uvareného mlieka vytvára charakteristický biely film – penu.
Cukor laktóza C^HdgO, ktorý je súčasťou mlieka, sa izomerizuje na sacharózu. V ľudskom tele sa pôsobením enzýmu laktázy tento cukor rozkladá na monosacharidy glukózu a galaktózu, ktoré sa ľahko vstrebávajú. Vďaka tomu si napríklad dojčatá dopĺňajú zásoby sacharidov. Je zaujímavé, že u mnohých ľudí (hlavne predstaviteľov mongoloidnej rasy) telo v dospelosti stráca schopnosť štiepiť laktózu.
Pri prechode cez tráviaci trakt sa laktóza neabsorbuje, ale stáva sa živnou pôdou pre vývoj rôznych patogénov, čo vedie k všeobecnej nevoľnosti. Preto národy Ďalekého východu (Japonci, Číňania) prakticky nepoužívajú mliečne výrobky v potravinách.
V priemyselných podmienkach sa mlieko podrobuje tepelnému spracovaniu, ktorého účelom je potlačiť vývoj mikroorganizmov a predĺžiť jeho trvanlivosť. Na tento účel sa mlieko pasterizuje - udržiava sa 30 minút pri 65 ° C a používa sa aj krátkodobé tepelné ošetrenie - zahrieva sa 10-20 s na 71 ° C. Tepelná úprava v porovnaní s pasterizáciou lepšie zachováva živiny, najmä vitamíny. Aby sa mlieko nerozdelilo na smotanu a srvátku, homogenizuje sa – prechádza pod tlakom cez malé otvory. Tukové guľôčky sa rozdrvia, zmenší sa a mlieko sa stane viskóznejším.
Značná časť mlieka ide na spracovanie – na výrobu masla, syrov a mliečnych výrobkov (kefír, fermentované pečené mlieko, kyslé mlieko, kyslá smotana).
Na získanie kefíru sa mlieko fermentuje - udržiava sa 8-10 hodín pri 20-25 ° C, pridáva sa semeno baktérií mliečneho kvasenia. Pod ich pôsobením sa laktóza rozkladá na kyselinu mliečnu:
Жн„о„ + n,o = laktóza == 4CH3CH(OH)COOH. kyselina mliečna (2-hydroxypropánová).
Práve kyselina mliečna určuje špecifickú chuť kefíru. Keď sa hromadí v roztoku, dochádza ku koagulácii (koagulácii) kazeínu, ktorý sa uvoľňuje vo voľnej forme. Preto má kefír hustejšiu konzistenciu ako mlieko. Mliečna fermentácia laktózy je sprevádzaná alkoholovou fermentáciou, vďaka ktorej sa v fermentované mliečne výrobky najmä v kefíre je malé množstvo alkoholu (do 0,03%). Fermentované mliečne výrobky tiež obsahujú mikroorganizmy, ktoré inhibujú rozvoj patogénnych baktérií a tým zlepšujú trávenie.
Tvaroh sa získava aj fermentáciou mlieka baktériami mliečneho kvasenia. Jeho hlavné neoddeliteľnou súčasťou je proteín kazeín.
Pripraviť maslo, zo srvátky je potrebné oddeliť kvapôčky tuku, ktoré tvoria mlieko. Na tento účel sa stúli smotana - horná, mastnejšia vrstva, ktorá sa tvorí pri usadzovaní mlieka.
Kazeín sa nachádza aj v syroch. Vyrábajú sa pridaním bakteriálneho štartéra a špeciálnych enzýmov do mlieka a následným zahriatím zmesi na určitú teplotu. Do uvoľnenej zrazeniny sa opäť zavádzajú enzýmy a zahrievajú sa. V tomto prípade dochádza k čiastočnej zmene štruktúry a zloženia kazeínu. Potom sa zmes rozloží do foriem a udržiava sa dlhú dobu - až šesť mesiacov - pri nízkej teplote (nie vyššej ako 15 ° C). Počas dozrievania sa kazeín pôsobením enzýmov rozkladá na polypeptidy a voľné aminokyseliny. Časť aminokyselín sa oxiduje vzdušným kyslíkom a vzniká amoniak, aldehydy a tiež ketokyseliny, ktoré dodávajú syru charakteristickú chuť.
Kyslé mlieko je bežným príkladom denaturácie bielkovín.
MEDENÁ KRV
V chladných vodách peruánskeho prúdu v Tichý oceán obývaná chobotnicou Dosidicus gigas. Jeho telo v tvare cigary spolu s chápadlami dosahuje dĺžku 3,5 m a hmotnosť obra môže presiahnuť 150 kg. Výkonné myši vyvrhujú prúd vody silou, ktorou bije z hasičskej hadice, vďaka čomu sa chobotnica dokáže pohybovať rýchlosťou až 40 km/h. So zobákom veľmi silným a ostrým dokáže zlomiť oceľové lanko. Podľa očitých svedkov chobotnica doslova roztrhá 20-kilogramovú rybu na kusy. Tento divoký predátor je pre ľudí veľmi nebezpečný. Kniha Franka Lanea The Kingdom of the Octopus uvádza, že „človek, ktorý spadne cez palubu na miestach, kde žije veľa chobotníc, nebude žiť ani pol minúty“.
Na „nabitie“ energiou potrebuje tento obyvateľ oceánu veľa kyslíka – najmenej 50 litrov za hodinu. Kyslík pochádzajúci z morskej vody je prenášaný cez telo chobotnice pomocou špeciálnej bielkoviny obsahujúcej meď - hemianín (z gréckeho "hema" - "krv" a "kyanos" - "azúrová", "modrá").
Stojí za zmienku, že v krvi stavovcov je kyslík „prepravovaný“ atómami železa v zložení hemu, špeciálnej komplexnej molekuly, ktorá je súčasťou proteínu hemoglobínu. Sú doslova preplnené červenými krvinkami – erytrocytmi. Molekula hemoglobínu obsahuje štyri fragmenty hemu, z ktorých každý je schopný viazať molekulu kyslíka. Na rozdiel od hemoglobínu sú v hemianíne atómy medi priamo spojené s molekulami proteínov, ktoré nie sú zahrnuté v žiadnych bunkách, ale „plávajú“ voľne v krvi. Ale jedna molekula hemoiiani
Je schopný viazať až 200 atómov medi. A je tu ešte jedna vlastnosť hemoiiani-na – jej molekuly sú obrovské aj na bielkoviny. „Obyčajné“ bielkoviny, ktoré tvoria vajcia, mlieko, myši, molekulová hmotnosť sa pohybuje od 6 tisíc do 1 milióna a molekulová hmotnosť hemianínu môže dosiahnuť 10 miliónov! Toto je jeden z najväčších proteínov; len proteínové komplexy vírusov majú väčšiu veľkosť a hmotnosť.
Hemoiyanin je veľmi stará veverička. Je to jednoduchšie ako hemoglobín a nie také účinné. Napriek tomu pri nízkom obsahu kyslíka v morskej vode hemianín celkom úspešne zásobuje tkanivá studenokrvných živočíchov kyslíkom. Tlak kyslíka v žiabrách homára je teda iba 7 mm Hg. čl. (930 Pa) a v tkanivách - 3 mm Hg. čl.; Okrem toho je koncentrácia tohto plynu v krvi homára 20-krát vyššia ako v morskej vode.
Okrem kalamárov prenášajú kyslík „modrou krvou“ aj desaťnohé kôrovce (homáre, kraby, krevety). Hemoiian nájdený v každom hlavonožce(chobotnice, chobotnice, sépie), rôzne slimáky, pavúky atď. hrebenatky, ustrice a iné lastúrniky nie sú prítomné.
Množstvo hemianínu v krvi môže byť veľmi odlišné. Takže v šikovnej chobotnici a krabovi podkovy (morské zviera typu článkonožcov) dosahuje koncentrácia tohto nezvyčajného proteínu 10 g na 100 ml krvi - takmer rovnaké množstvo hemoglobínu v ľudskej krvi. Pritom mäkkýš jedlý prisedlý Hatiotis tuberculata má len 0,03 g hemianínu v 100 ml krvi. Je to pochopiteľné: čím aktívnejšie je zviera,
Čím viac kyslíka potrebuje na doplnenie nákladov na energiu, tým vyššia je koncentrácia bielkovín prenášajúcich kyslík v krvi.
Hemoianín bol objavený v 60. rokoch. storočia, keď si biológovia všimli, že krv hlavonožcov pri prechode cez žiabre zmodrie. A v roku 1878 belgický fyziológ Leon Frederick dokázal, že modrá farba je spôsobená reakciou kyslíka s proteínom obsahujúcim meď, ktorý nazval hemianín. Keď druhý stratí kyslík, na rozdiel od hemoglobínu sa stane bezfarebným. Je pozoruhodné, že Frederick dokončil všetku prácu na štúdiu nového proteínu v priebehu jedného dňa.
Úplne extrahovať meď z hemianínu nie je ťažké. Alya, stačí ošetriť proteín v neprítomnosti kyslíka činidlom, ktoré sa silne viaže na jednomocné ióny medi. Rovnakým spôsobom môžete určiť obsah medi v hemianíne. Bez tohto kovu stráca schopnosť prenášať kyslík. Ak sa však do proteínového roztoku zavedú ióny Cu-1, hemianín obnoví svoju fyziologickú aktivitu.
Bolo teda dokázané, že v neprítomnosti kyslíka je meď hemianínu v oxidačnom stave +1. Pri prebytku tohto plynu dochádza k čiastočnej oxidácii kovu. V tomto prípade sú vždy dva atómy medi na molekulu kyslíka viazaného na hemianín. Kyslík teda oxiduje presne polovicu atómov medi. Toto je ďalší rozdiel medzi hemianínom a hemoglobínom, ktorý je oveľa bežnejší vo svete zvierat, v ktorom sú všetky atómy železa rovnaké a majú náboj +2 vo voľnom stave aj v kombinácii s kyslíkom.