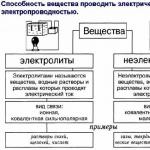
Elektrolyty sú látky, ktorých taveniny alebo roztoky vedú elektrický prúd. Elektrolyty zahŕňajú kyseliny, zásady a väčšinu solí.
Disociácia elektrolytov
Elektrolyty sú látky s iónovými alebo vysoko polárnymi kovalentnými väzbami. Prvé existujú vo forme iónov ešte predtým, ako sa prenesú do rozpusteného alebo roztaveného stavu. Elektrolyty zahŕňajú soli, zásady, kyseliny.

Ryža. 1. Tabuľkový rozdiel medzi elektrolytmi a neelektrolytmi.
Rozlišujte medzi silnými a slabými elektrolytmi. Silné elektrolyty, keď sa rozpustia vo vode, úplne disociujú na ióny. Patria sem: takmer všetky rozpustné soli, mnohé anorganické kyseliny (napríklad H 2 SO 4, HNO 3, HCl), hydroxidy alkalických kovov a kovov alkalických zemín. Slabé elektrolyty, keď sa rozpustia vo vode, mierne disociujú na ióny. Patria sem takmer všetky organické kyseliny, niektoré anorganické kyseliny (napríklad H 2 CO 3), mnohé hydroxidy (okrem hydroxidov alkalických kovov a kovov alkalických zemín).

Ryža. 2. Tabuľka silných a slabých elektrolytov.
Voda je tiež slabý elektrolyt.
Rovnako ako iné chemické reakcie, aj elektrolytická disociácia v roztokoch sa píše ako disociačné rovnice. Súčasne pre silné elektrolyty sa proces považuje za nevratný a pre elektrolyty strednej a slabej sily za reverzibilný proces.
kyseliny- Sú to elektrolyty, ktorých disociácia vo vodných roztokoch prebieha za vzniku vodíkových iónov ako katiónov. Viacsýtne kyseliny disociujú v krokoch. Každý ďalší krok ide so stále väčšími ťažkosťami, pretože výsledné ióny zvyškov kyselín sú slabšie elektrolyty.
základy- elektrolyty, ktoré disociujú vo vodnom roztoku za vzniku hydroxidového iónu OH- ako aniónu. Tvorba hydroxidového iónu je spoločnou vlastnosťou zásad a určuje všeobecné vlastnosti silných zásad: zásaditý charakter, horká chuť, mydlivosť na dotyk, reakcia na indikátor, neutralizácia kyselín atď.
Alkálie, aj slabo rozpustné (napríklad hydroxid bárnatý Ba (OH) 2) disociujú úplne, napr.
Ba (OH) 2 \u003d Ba2 + 2OH-
soľ- sú to elektrolyty, ktoré disociujú vo vodnom roztoku za vzniku kovového katiónu a zvyšku kyseliny. Soli sa nedisociujú postupne, ale úplne:
Ca (NO 3) 2 \u003d Ca 2 + + 2 NO 3 -
Teória elektrolytickej disociácie
elektrolytov- látky, ktoré v roztokoch alebo taveninách podliehajú elektrolytickej disociácii a pohybom iónov vedú elektrický prúd.
Elektrolytická disociácia je rozklad elektrolytov na ióny, keď sú rozpustené vo vode.
Teória elektrolytickej disociácie (S. Arrhenius, 1887) v modernom zmysle obsahuje tieto ustanovenia:
- Elektrolyty sa po rozpustení vo vode rozkladajú (disociujú) na ióny – pozitívne (katióny) a negatívne (anióny). K ionizácii dochádza najľahšie pri zlúčeninách s iónovou väzbou (soli, alkálie), ktoré po rozpustení (endotermický proces deštrukcie kryštálovej mriežky) tvoria hydratované ióny.

Ryža. 3. Schéma elektrolytickej disociácie soli.
Hydratácia iónov je exotermický proces. Pomer nákladov na energiu a ziskov určuje možnosť ionizácie v roztoku. Pri rozpustení látky s polárnou kovalentnou väzbou (napríklad chlorovodík HCl) sa vodné dipóly orientujú na zodpovedajúce póly rozpustenej molekuly, polarizujú väzbu a premenia ju na iónovú, po ktorej nasleduje hydratácia iónov. Tento proces je reverzibilný a môže prejsť buď úplne alebo čiastočne.
- hydratované ióny sú stabilné a v roztoku sa pohybujú náhodne. Pod pôsobením elektrického prúdu získava pohyb smerovaný charakter: katióny sa pohybujú smerom k zápornému pásu (katóda) a anióny - smerom k kladnému pásu (anóda).
- disociácia (ionizácia) je reverzibilný proces. Úplnosť ionizácie závisí od charakteru elektrolytu (alkalické soli disociujú takmer úplne), jeho koncentrácie (ionizácia sa stáva ťažšou so zvyšujúcou sa koncentráciou), teploty (zvýšenie teploty podporuje disociáciu), povahy rozpúšťadla (ionizácia sa vyskytuje iba v polárnom rozpúšťadle, najmä vo vode).
- (grécky). Kvapalné teleso rozložené elektrickým (galvanickým) prúdom. Slovník cudzích slov zahrnutých v ruskom jazyku. Chudinov A.N., 1910. ELEKTROLYT Kvapalina podliehajúca rozkladu galvanickým prúdom. ... ... Slovník cudzích slov ruského jazyka
elektrolyt- a, m. elektrolyt m. elektro + gr. lytos je odbúrateľný. špecialista. Chemická látka (v tavenine alebo roztoku), ktorá sa môže pri prechode elektrického prúdu rozložiť na jednotlivé časti. elektrolyt batérie. BASS 1. Hádzanie ...... Historický slovník galicizmov ruského jazyka
elektrolyt- Roztok, v ktorom pri prechode elektrického prúdu dochádza k rozkladu látky, čo vedie k vzniku elektrického prúdu. Elektrolyt je základom akumulátorov a batérií. [Hypertextový encyklopedický slovník na ... ... Technická príručka prekladateľa
ELEKTROLYT- ELEKTROLYT, roztok alebo roztavená soľ schopná viesť elektrický prúd a používaná na ELEKTROLYZU (pri ktorej sa rozkladá). Prúd v elektrolytoch je vedený nabitými iónmi, nie elektrónmi. Napríklad v olove ... ... Vedecko-technický encyklopedický slovník
ELEKTROLYT- ELEKTROLYT, elektrolyt, manžel. (od slova elektrický a grécky lytos rozpustený) (fyzický). Roztok látky, ktorú možno elektrolýzou rozložiť na jednotlivé časti. Vysvetľujúci slovník Ushakov. D.N. Ušakov. 1935 1940 ... Vysvetľujúci slovník Ushakova
elektrolyt- podstatné meno, počet synoným: 1 katolyt (1) ASIS Slovník synonym. V.N. Trishin. 2013... Slovník synonym
Elektrolyt- Elektrolyty sú látky, roztoky a zliatiny, ktorých s inými látkami elektrolyticky vedú galvanický prúd. Za znak elektrolytickej vodivosti, na rozdiel od kovovej, treba považovať schopnosť pozorovať chemické ... ... Encyklopédia Brockhausa a Efrona
elektrolyt- - látka, ktorej vodný roztok alebo tavenina vedie elektrický prúd. Všeobecná chémia: učebnica / A. V. Zholnin ... Chemické termíny
ELEKTROLYT- látka, ktorej vodný roztok alebo tavenina vedie elektrický prúd (pozri), vznikajúci pri elektrolytickom (pozri). Tento E., tiež nazývaný (pozri) druhý druh, sa líši od kovov (vodičov prvého druhu), v ktorých je prenos ... Veľká polytechnická encyklopédia
knihy
- , Gorichev Igor Georgievich , Atanasyan T. K. , Yakusheva E. A. Kategória: Rôzne Vydavateľ: Prometheus, Výrobca: Prometheus, Kúpiť za 483 UAH (iba Ukrajina)
- Anorganická chémia. Časť I. Povrchové javy na rozhraní oxid/elektrolyt v kyslom prostredí , Gorichev Igor Georgievich , Atanasyan T. K. , Yakusheva E. A. elektrická dvojvrstva na... Kategória: Chemické vedy Vydavateľ: Prometheus, Kúpiť za 377 rubľov
- Anorganická chémia, časť I, povrchové javy na hranici oxid-elektrolyt v kyslom médiu, výučba,
V časti o otázke Aké látky sú elektrolyty? daný autorom Oľga Dubrovina najlepšia odpoveď je Látky, ktoré sa v roztokoch alebo taveninách rozkladajú na ióny, a preto vedú elektrický prúd, sa nazývajú elektrolyty. Látky, ktoré sa za rovnakých podmienok nerozkladajú na ióny a nevedú elektrický prúd, sa nazývajú neelektrolyty. Silné elektrolyty sú látky, ktoré sa po rozpustení vo vode takmer úplne rozložia na ióny. K silným elektrolytom patria spravidla látky s iónovými alebo vysoko polárnymi väzbami: všetky vysoko rozpustné soli, silné kyseliny (HCl, HBr, HI, HClO4, H2SO4, HNO3) a silné zásady (LiOH, NaOH, KOH, RbOH, CsOH, Ba (OH) 2, Sr (OH) 2, Ca (OH) 2. V silnom roztoku elektrolytu je rozpustená látka hlavne vo forme iónov (katiónov a aniónov); nedisociované molekuly prakticky chýbajú.slabé elektrolyty látky, ktoré čiastočne disociujú na ióny. Roztoky slabých elektrolytov spolu s iónmi obsahujú nedisociované molekuly. Slabé elektrolyty nemôžu poskytnúť vysokú koncentráciu iónov v roztoku. Medzi slabé elektrolyty patria: 1) takmer všetky organické kyseliny (CH3COOH, C2H5COOH atď.); 2) niektoré anorganické kyseliny (H2CO3, H2S atď.); 3) takmer všetky zle rozpustné soli, zásady a hydroxid amónny vo vode (Ca3 (PO4) 2; Cu (OH) 2; Al (OH) 3; NH4OH); 4) voda. Zle (alebo takmer nevedú) elektrický prúd. СH3COOH « CH3COO - + H+Cu(OH)2 « + + OH- (prvý stupeň)+ « Cu2+ + OH- (druhý stupeň) H2CO3 « H+ + HCO- (prvý stupeň) HCO3- « H+ + CO32- (druhý stupeň)
Odpoveď od Prosyanka[guru]
kyseliny, zásady a niektoré soli
Odpoveď od Európsky[guru]
Áno, kyseliny, soli a zásady, ale všeobecne tí, ktorí v rozpustenom stave tak nevedú v čistej forme
Odpoveď od Prispôsobivosť[guru]
Všetky, ktoré sa vo vode disociujú na ióny .. :-))
Odpoveď od Anel Saduakasová[nováčik]
ELEKTROLYTY sú roztoky solí, kyselín a zásad, ako aj roztavených solí a kovov. Elektrolyty sú dobrými vodičmi elektrického prúdu.
Odpoveď od Olia Titová[nováčik]
všetky vysoko rozpustné soli, silné kyseliny (HCl, HBr, HI, HClO4, H2SO4, HNO3) a silné zásady (LiOH, NaOH, KOH, RbOH, CsOH, Ba(OH)2,Sr(OH)2,Ca(OH) 2).
Odpoveď od Yohlana[majster]
Elektrolyty zahŕňajú: kyseliny, soli, zásady
Odpoveď od Ling Kwon[nováčik]
S iónovým a kovalentným polárnym typom chemickej väzby.
Elektrolyty ako chemikálie sú známe už od staroveku. Väčšinu oblastí ich použitia si však podmanili relatívne nedávno. Budeme diskutovať o najprioritnejších oblastiach, v ktorých tento priemysel používa tieto látky, a zistíme, čo sú tieto látky a ako sa navzájom líšia. Začnime však exkurziou do histórie.
Príbeh
Najstaršie známe elektrolyty sú soli a kyseliny objavené v staroveku. Predstavy o štruktúre a vlastnostiach elektrolytov sa však časom vyvíjali. Teórie týchto procesov sa vyvíjali od 80. rokov 19. storočia, kedy bolo urobených množstvo objavov súvisiacich s teóriami vlastností elektrolytov. Došlo k niekoľkým kvalitatívnym skokom v teóriách popisujúcich mechanizmy interakcie elektrolytov s vodou (veď až v roztoku získavajú vlastnosti, vďaka ktorým sa využívajú v priemysle).
Teraz podrobne rozoberieme niekoľko teórií, ktoré mali najväčší vplyv na vývoj predstáv o elektrolytoch a ich vlastnostiach. A začnime najbežnejšou a najjednoduchšou teóriou, ktorú každý z nás absolvoval v škole.
Arrheniova teória elektrolytickej disociácie
v roku 1887 švédsky chemik a Wilhelm Ostwald vytvorili teóriu elektrolytickej disociácie. Ani tu však nie je všetko také jednoduché. Sám Arrhenius bol zástancom takzvanej fyzikálnej teórie roztokov, ktorá nebrala do úvahy interakciu zložiek s vodou a tvrdila, že v roztoku sú voľné nabité častice (ióny). Mimochodom, práve z takýchto pozícií sa dnes v škole uvažuje o elektrolytickej disociácii.
Povedzme si, čo táto teória dáva a ako nám vysvetľuje mechanizmus interakcie látok s vodou. Ako každá iná, má niekoľko postulátov, ktoré používa:
1. Pri interakcii s vodou sa látka rozkladá na ióny (pozitívny - katión a negatívny - anión). Tieto častice podliehajú hydratácii: priťahujú molekuly vody, ktoré sú, mimochodom, na jednej strane kladne nabité a na druhej strane záporne (tvoria dipól), v dôsledku čoho sa formujú do akvakomplexov (solváty).
2. Proces disociácie je reverzibilný - to znamená, že ak sa látka rozpadla na ióny, potom sa pod vplyvom akýchkoľvek faktorov môže opäť zmeniť na pôvodnú.
3. Ak pripojíte elektródy k roztoku a zapnete prúd, potom sa katióny začnú pohybovať smerom k zápornej elektróde - katóde a anióny smerom ku kladne nabitej - anóde. Preto látky, ktoré sú vysoko rozpustné vo vode, vedú elektrinu lepšie ako samotná voda. Z rovnakého dôvodu sa nazývajú elektrolyty.
4. elektrolyt charakterizuje percento látky, ktorá prešla rozpustením. Tento indikátor závisí od vlastností rozpúšťadla a samotnej rozpustenej látky, od ich koncentrácie a od vonkajšej teploty.
Tu sú v skutočnosti všetky hlavné postuláty tejto jednoduchej teórie. V tomto článku ich použijeme na opis toho, čo sa deje v roztoku elektrolytu. Príklady týchto zlúčenín budeme analyzovať o niečo neskôr, ale teraz zvážime inú teóriu.

Lewisova teória kyselín a zásad
Podľa teórie elektrolytickej disociácie je kyselina látka, v ktorej roztoku je prítomný vodíkový katión a zásada je zlúčenina, ktorá sa v roztoku rozkladá na hydroxidový anión. Existuje ďalšia teória pomenovaná po slávnom chemikovi Gilbertovi Lewisovi. Umožňuje vám trochu rozšíriť pojem kyseliny a zásady. Podľa Lewisovej teórie sú kyseliny molekuly látky, ktoré majú voľné elektrónové orbitály a sú schopné prijať elektrón z inej molekuly. Je ľahké uhádnuť, že bázami budú také častice, ktoré sú schopné darovať jeden alebo viacero svojich elektrónov na „využitie“ kyseliny. Tu je veľmi zaujímavé, že nielen elektrolyt, ale aj akákoľvek látka, dokonca aj nerozpustná vo vode, môže byť kyselina alebo zásada.

Protolitická Brendsted-Lowryho teória
V roku 1923, nezávisle od seba, dvaja vedci – J. Bronsted a T. Lowry – navrhli teóriu, ktorú dnes vedci aktívne využívajú na opis chemických procesov. Podstatou tejto teórie je, že význam disociácie je redukovaný na prenos protónu z kyseliny na zásadu. Posledný menovaný sa tu teda chápe ako akceptor protónov. Potom je kyselina ich darcom. Teória tiež dobre vysvetľuje existenciu látok, ktoré vykazujú vlastnosti kyselín aj zásad. Takéto zlúčeniny sa nazývajú amfotérne. V Bronsted-Lowryho teórii sa pre ne používa aj termín amfolyty, zatiaľ čo kyseliny alebo zásady sa zvyčajne nazývajú protolity.
Dostali sme sa k ďalšej časti článku. Tu vám povieme, ako sa od seba líšia silné a slabé elektrolyty a rozoberieme vplyv vonkajších faktorov na ich vlastnosti. A potom pristúpime k popisu ich praktickej aplikácie.
Silné a slabé elektrolyty
Každá látka interaguje s vodou individuálne. Niektoré sa v ňom dobre rozpúšťajú (napríklad kuchynská soľ), niektoré sa nerozpustia vôbec (napríklad krieda). Všetky látky sú teda rozdelené na silné a slabé elektrolyty. Posledne menované sú látky, ktoré zle interagujú s vodou a usadzujú sa na dne roztoku. To znamená, že majú veľmi nízky stupeň disociácie a vysokú energiu väzby, ktorá za normálnych podmienok nedovoľuje molekule, aby sa rozložila na jej základné ióny. K disociácii slabých elektrolytov dochádza buď veľmi pomaly, alebo so zvýšením teploty a koncentrácie tejto látky v roztoku.
Hovorme o silných elektrolytoch. Patria sem všetky rozpustné soli, ako aj silné kyseliny a zásady. Ľahko sa rozpadajú na ióny a je veľmi ťažké ich zhromaždiť v zrážkach. Prúd v elektrolytoch sa mimochodom vykonáva presne vďaka iónom obsiahnutým v roztoku. Preto silné elektrolyty vedú prúd najlepšie zo všetkých. Príklady posledne menovaných: silné kyseliny, zásady, rozpustné soli.

Faktory ovplyvňujúce správanie elektrolytov
Teraz poďme zistiť, ako zmena vonkajšieho prostredia ovplyvňuje koncentráciu priamo ovplyvňuje stupeň disociácie elektrolytu. Navyše tento pomer možno vyjadriť matematicky. Zákon popisujúci toto spojenie sa nazýva Ostwaldov zákon riedenia a je napísaný takto: a = (K / c) 1/2. Tu a je stupeň disociácie (počítaný v zlomkoch), K je disociačná konštanta, ktorá je pre každú látku iná, a c je koncentrácia elektrolytu v roztoku. Pomocou tohto vzorca sa môžete dozvedieť veľa o látke a jej správaní v roztoku.
Ale to odbočujeme od témy. Okrem koncentrácie je stupeň disociácie ovplyvnený aj teplotou elektrolytu. U väčšiny látok jeho zvýšenie zvyšuje rozpustnosť a reaktivitu. To môže vysvetliť výskyt niektorých reakcií iba pri zvýšených teplotách. Za normálnych podmienok idú buď veľmi pomaly, alebo v oboch smeroch (takýto proces sa nazýva reverzibilný).
Analyzovali sme faktory, ktoré určujú správanie systému, akým je napríklad roztok elektrolytu. Teraz prejdime k praktickej aplikácii týchto nepochybne veľmi dôležitých chemikálií.

Priemyselné využitie
Samozrejme, každý už počul slovo „elektrolyt“ v súvislosti s batériami. Auto používa olovené akumulátory, ktorých elektrolytom je 40% kyselina sírová. Aby sme pochopili, prečo je táto látka vôbec potrebná, stojí za to pochopiť vlastnosti prevádzky batérií.
Aký je teda princíp fungovania akejkoľvek batérie? V nich dochádza k reverzibilnej reakcii premeny jednej látky na druhú, v dôsledku čoho sa uvoľňujú elektróny. Pri nabíjaní batérie dochádza k interakcii látok, ktorá sa za normálnych podmienok nedosiahne. Dá sa to vyjadriť ako akumulácia elektriny v látke v dôsledku chemickej reakcie. Keď začne vybíjanie, začne sa spätná transformácia, ktorá vedie systém do počiatočného stavu. Tieto dva procesy spolu tvoria jeden cyklus nabíjania a vybíjania.
Zvážte vyššie uvedený proces na konkrétnom príklade - olovenej batérii. Ako asi tušíte, tento zdroj prúdu pozostáva z prvku obsahujúceho olovo (ako aj oxidu olovnatého PbO 2) a kyseliny. Akákoľvek batéria pozostáva z elektród a priestoru medzi nimi naplneného len elektrolytom. Ako posledná, ako sme už zistili, je v našom príklade použitá kyselina sírová v koncentrácii 40 percent. Katóda takejto batérie je vyrobená z oxidu olovnatého a anóda je vyrobená z čistého olova. To všetko preto, že na týchto dvoch elektródach dochádza k rôznym reverzibilným reakciám za účasti iónov, na ktoré sa kyselina disociovala:
- PbO2 + SO4 2- + 4H + + 2e - \u003d PbSO4 + 2H20 (reakcia prebiehajúca na zápornej elektróde - katóde).
- Pb + SO 4 2- - 2e - \u003d PbSO 4 (Reakcia na kladnej elektróde - anóde).
Ak čítame reakcie zľava doprava - dostaneme procesy, ktoré sa vyskytujú pri vybití batérie, a ak sprava doľava - pri nabíjaní. Každá z týchto reakcií je iná, ale mechanizmus ich vzniku je vo všeobecnosti opísaný rovnako: prebiehajú dva procesy, pri jednom z nich sa elektróny „pohlcujú“ a pri druhom naopak „odchádzajú“. Najdôležitejšie je, že počet absorbovaných elektrónov sa rovná počtu emitovaných.
V skutočnosti okrem batérií existuje veľa aplikácií týchto látok. Vo všeobecnosti sú elektrolyty, ktorých príklady sme uviedli, len zrnkom množstva rôznych látok, ktoré sa spájajú pod týmto pojmom. Obklopujú nás všade, všade. Vezmime si napríklad ľudské telo. Myslíte si, že tieto látky tam nie sú? veľmi sa mýliš. Sú všade v nás a najväčšie množstvo tvoria krvné elektrolyty. Patria sem napríklad ióny železa, ktoré sú súčasťou hemoglobínu a pomáhajú transportovať kyslík do tkanív nášho tela. Krvné elektrolyty tiež zohrávajú kľúčovú úlohu pri regulácii rovnováhy voda-soľ a funkcie srdca. Túto funkciu vykonávajú ióny draslíka a sodíka (dokonca v bunkách prebieha proces, ktorý sa nazýva pumpa draslíka a sodíka).
Akékoľvek látky, ktoré môžete aspoň trochu rozpustiť, sú elektrolyty. A taký priemysel a náš život s vami neexistuje, kdekoľvek sa uplatňujú. Nejde len o batérie v autách a batérie. Ide o akúkoľvek chemickú a potravinársku výrobu, vojenské závody, odevné továrne a pod.
Mimochodom, zloženie elektrolytu je iné. Je teda možné rozlíšiť kyslý a alkalický elektrolyt. Zásadne sa líšia svojimi vlastnosťami: ako sme už povedali, kyseliny sú donory protónov a zásady akceptory. Ale v priebehu času sa zloženie elektrolytu mení v dôsledku straty časti látky, koncentrácia sa buď znižuje alebo zvyšuje (všetko závisí od toho, čo sa stratí, voda alebo elektrolyt).
Stretávame sa s nimi každý deň, no málokto presne pozná definíciu takého pojmu ako elektrolyty. Rozoberali sme príklady konkrétnych látok, prejdime teda k trochu zložitejším pojmom.

Fyzikálne vlastnosti elektrolytov
Teraz o fyzike. Najdôležitejšou vecou, ktorú je potrebné pochopiť pri štúdiu tejto témy, je spôsob prenosu prúdu v elektrolytoch. Rozhodujúcu úlohu v tom zohrávajú ióny. Tieto nabité častice môžu prenášať náboj z jednej časti roztoku do druhej. Anióny majú teda vždy sklon k kladnej elektróde a katióny k zápornej elektróde. Pôsobením na roztok elektrickým prúdom teda oddeľujeme náboje na rôznych stranách systému.
Takáto fyzikálna charakteristika ako hustota je veľmi zaujímavá. Mnoho vlastností zlúčenín, o ktorých diskutujeme, závisí od toho. A často sa objavuje otázka: "Ako zvýšiť hustotu elektrolytu?" V skutočnosti je odpoveď jednoduchá: musíte znížiť obsah vody v roztoku. Pretože hustota elektrolytu je väčšinou určená, väčšinou závisí od koncentrácie elektrolytu. Plán je možné realizovať dvoma spôsobmi. Prvý je celkom jednoduchý: prevarte elektrolyt obsiahnutý v batérii. K tomu ho treba nabiť tak, aby teplota vo vnútri vystúpila mierne nad sto stupňov Celzia. Ak táto metóda nepomôže, nebojte sa, existuje ďalšia: jednoducho vymeňte starý elektrolyt za nový. Za týmto účelom vypustite starý roztok, vyčistite vnútro od zvyškov kyseliny sírovej destilovanou vodou a potom nalejte novú dávku. Spravidla majú vysokokvalitné roztoky elektrolytov okamžite požadovanú koncentráciu. Po výmene môžete na dlhú dobu zabudnúť, ako zvýšiť hustotu elektrolytu.
Zloženie elektrolytu do značnej miery určuje jeho vlastnosti. Charakteristiky, ako napríklad elektrická vodivosť a hustota, sú veľmi závislé od povahy rozpustenej látky a jej koncentrácie. Existuje samostatná otázka o tom, koľko elektrolytu môže byť v batérii. V skutočnosti jeho objem priamo súvisí s deklarovanou silou produktu. Čím viac kyseliny sírovej je vo vnútri batérie, tým je výkonnejšia, t. j. tým väčšie napätie dokáže dodať.

Kde je to užitočné?
Ak ste automobilový nadšenec alebo len milujete autá, potom sami rozumiete všetkému. Určite dokonca viete, ako zistiť, koľko elektrolytu je teraz v batérii. A ak ste ďaleko od áut, potom poznať vlastnosti týchto látok, ich aplikácie a ich vzájomné pôsobenie nebude vôbec zbytočné. Keď to viete, nebudete v rozpakoch, ak vás požiadajú, aby ste povedali, ktorý elektrolyt je v batérii. Hoci aj keď nie ste nadšencom automobilov, ale máte auto, znalosť batériového zariadenia nebude vôbec zbytočná a pomôže vám s opravami. Bude oveľa jednoduchšie a lacnejšie robiť všetko sami, ako ísť do autocentra.
A aby ste si túto tému lepšie naštudovali, odporúčame prečítať si učebnicu chémie pre školy a univerzity. Ak túto vedu dobre poznáte a máte prečítaných dostatok učebníc, Varypajevove „Chemické prúdové zdroje“ by boli najlepšou voľbou. Podrobne načrtáva celú teóriu fungovania batérií, rôznych batérií a vodíkových článkov.
Záver
Došli sme na koniec. Poďme si to zhrnúť. Vyššie sme analyzovali všetko, čo súvisí s takou koncepciou, ako sú elektrolyty: príklady, teória štruktúry a vlastností, funkcie a aplikácie. Ešte raz treba povedať, že tieto zlúčeniny sú súčasťou nášho života, bez ktorých by naše telá a všetky oblasti priemyslu nemohli existovať. Pamätáte si krvné elektrolyty? Vďaka nim žijeme. A čo naše autá? S týmito znalosťami budeme schopní vyriešiť akýkoľvek problém súvisiaci s batériou, pretože teraz chápeme, ako zvýšiť hustotu elektrolytu v nej.
Nedá sa povedať všetko a takýto cieľ sme si nedali. To napokon nie je všetko, čo sa o týchto úžasných látkach dá povedať.
Krátka verzia materiálu na tému "Elektrolyty a neelektrolyty". Umožňuje vám rýchlo sa zorientovať v téme, tk. prezentované vo forme tabuľky s definíciami a príkladmi. Pomôže to systematizovať vedomosti, pripraviť sa na overovanie a testovanie.
Zobraziť obsah dokumentu
"Postýlka "Elektrolyty a neelektrolyty""
LÁTKY
| elektrolytov | neelektrolytov |
| vodiče druhého druhu | (pretože netvoria ióny) |
| látky s
kyseliny(HCl, HN03, CH3COOH) , dôvody(KOH, NaOH, Ba (OH) 2), soľ(KCl, NH4NO3, MgS04), voda | látky s
Organické zlúčeniny jednoduché látky nekovy(N2, O2, H2) |
ELEKTROLYTY
| silný | slabý |
| stupeň disociácie je menší ako 3 % |
|
| všetky soli silné kyseliny silné základy(LiOH, KOH, NaOH, Ba(OH) 2)) | slabýkyseliny slabé základy |
| pri zriedení sa môže stať silným. |
|
Stupeň disociácie (α)
α = N spread. / N celkom
_____________________________________________________________________________________
Podľa schopnosti viesť prúd vo vodnom roztoku alebo tavenine
LÁTKY
| elektrolytov | neelektrolytov |
| viesť prúd v roztoku alebo tavenine (pretože existujú nabité častice - ióny), vodiče druhého druhu | neveďte prúd v roztoku alebo tavenine (pretože netvoria ióny) |
| látky s iónová alebo vysoko polárna kovalentná väzba kyseliny(HCl, HN03, CH3COOH) , dôvody(KOH, NaOH, Ba (OH) 2), soľ(KCl, NH4NO3, MgS04), voda | látky s nepolárna alebo slabo polárna kovalentná väzba Organické zlúčeniny(uhľovodíky, sacharóza, alkoholy), jednoduché látky nekovy(N2, O2, H2) |
ELEKTROLYTY
| silný | slabý |
| stupeň disociácie je viac ako 30% | stupeň disociácie je menší ako 3 % |
| všetky soli– rozpustné aj slabo rozpustné; silné kyseliny(HCl, HBr, HI, HN03, HC103, HC104, H2S04 (zried.)); silné základy(LiOH, KOH, NaOH, Ba(OH) 2)) | slabýkyseliny(H2S, H2S03, H2C03, H2Si03, CH3COOH); slabé základy- nerozpustné hydroxidy kovov a NH 4 OH. |
| Stupeň disociácie závisí od koncentrácie látky v roztoku, takže niektoré slabé elektrolyty pri zriedení sa môže stať silným. |
|
Stupeň disociácie (α) je pomer počtu molekúl rozložených na ióny (rozpad N) k celkovému počtu rozpustených molekúl (celkom N)
α = N spread. / N celkom