tiokyanáty(tiokyanidy, tiokyanidy, sulfokyanidy) - soli kyseliny tiokyanovej (tiokyanovej).
Štruktúra
Predtým bol rozšírený názor, že kyselina tiokyanová je zmesou dvoch tautomérov:
texvc nenájdené; Pomoc s nastavením nájdete v časti math/README.): \mathsf(H\text(-)S\text(-)C\ekviv N \šípky doprava doľava H\text(-)N\text(=)C\text(= )S )
ale neskôr sa ukázalo, že kyselina má štruktúru HNCS. Tiokyanáty alkalických kovov a amónne majú vzorec Me + NCS -, pre ostatné tiokyanáty je možný vzorec Me(SCN)x.
Fyzikálno-chemické vlastnosti
Anorganické tiokyanáty sú kryštalické látky s vysokou teplotou topenia.
Anorganické tiokyanáty vstupujú do oxidačných, redukčných, halogenačných a výmenných reakcií:
Nedá sa analyzovať výraz (spustiteľný súbortexvc nenájdené; Pomoc s nastavením nájdete v časti math/README.): \mathsf(NH_4NCS + O_2 + H_2O \rightarrow NH_4HSO_4 + HCN)
Nedá sa analyzovať výraz (spustiteľný súbor texvc nenájdené; Pomoc s nastavením nájdete v časti math/README.): \mathsf(NaNCS + Fe \rightarrow NaCN + FeS)
Nedá sa analyzovať výraz (spustiteľný súbor texvc nenájdené; Pomoc s nastavením nájdete v časti math/README.): \mathsf(KNCS + Zn + HCl \rightarrow Cl + KCl + ZnCl_2)
Nedá sa analyzovať výraz (spustiteľný súbor texvc nenájdené; Pomoc pri ladení nájdete v matematickom/README.): \mathsf(KNCS + Br_2 + H_2O \rightarrow BrCN + K_2SO_4 + HBr)
Nedá sa analyzovať výraz (spustiteľný súbor texvc nenájdené; Pomoc s nastavením nájdete v časti math/README.): \mathsf(2KNCS + Pb(NO)_3)_2 \rightarrow Pb(SCN)_2 + 2KNO_3)
Okrem toho môžu tiokyanáty vytvárať komplexné zlúčeniny. V nich môže byť ligand - tiokyanátový ión - koordinovaný tak atómom dusíka, ako aj atómom síry, napríklad tetrarodanoželezitan draselný: K. Reakcia vzniku krvavočerveno sfarbeného tetrarodanoželeznatanu draselného slúži v analytická chémia kvalitatívna reakcia na ión Fe 3+.
Tepelnou izomerizáciou tiokyanatanu amónneho vzniká tiomočovina:
Nedá sa analyzovať výraz (spustiteľný súbortexvc nenájdené; Pomoc s nastavením nájdete v časti math/README.): \mathsf(NH_4NCS \xrightarrow(180^oC) (NH_2)_2CS)
V analytickej chémii sa používajú ako činidlo pre železité ióny, s ktorými tvoria krvavočervené tiokyanátové komplexy Fe (III), ako aj na fotometrické stanovenie niektorých kovov (napríklad kobaltu, železa, bizmutu, molybdénu, volfrám, rénium).
Tiokyanáty sa používajú pri výrobe tiomočoviny, sú činidlá v procesoch farbenia a potlače látok, v analytickej chémii (kvalitatívne a kvantitatívne analýzy), ako pesticídy (insekticídy a fungicídy), stabilizátory na spaľovanie výbušnín, v procesoch izolácie a separáciu vzácnych kovov na získanie organických tiokyanátov. Tiokyanáty nióbu(V) a tantalu(V) slúžia ako katalyzátory Friedel-Craftsovej reakcie.
Biologická úloha
Tiokyanáty sú relatívne málo toxické (napríklad LD 50 pre NaNCS je 370 mg/kg), ale môžu dráždiť kožu, pôsobiť na štítnu žľazu, obličky a spôsobiť xanthopsiu. Toxicita tiokyanátov ťažkých kovov je určená hlavne toxicitou kovových iónov a nie tiokyanátovým iónom.
Tiokyanáty sa nachádzajú v živých organizmoch: v slinách a žalúdočnej šťave zvierat, cibuľovej šťave Allium coepa a korene niektorých rastlín.
Napíšte recenziu na článok "Anorganické tiokyanáty"
Literatúra
- Žefirov N.S. atď. v.4 Half-Three // Chemická encyklopédia. - M .: Veľká ruská encyklopédia, 1995. - 639 s. - 20 000 kópií. - ISBN 5-85270-092-4.
Výňatok charakterizujúci anorganické tiokyanáty
– Nie, Isidora, to nie je pravda. Katari v Krista „neverili“, obracali sa k nemu, prihovárali sa mu. Bol ich učiteľom. Ale nie Bohom. V Boha môžeš len slepo veriť. Aj keď stále nechápem, ako človek potrebuje slepú vieru? Táto cirkev opäť raz nesprávne vyložila význam učenia niekoho iného... Katari verili V POZNATIE. V úprimnosti a pomoci iným, menej šťastným ľuďom. Verili v dobro a lásku. Nikdy však neverili v jednu osobu. Radomira milovali a vážili si ho. A zbožňovali Zlatú Máriu, ktorá ich učila. Ale nikdy z nich nestvorili Boha ani Bohyňu. Boli pre nich symbolmi mysle a cti, poznania a lásky. Stále to však boli ĽUDIA, ktorí sa úplne odovzdali iným.Pozri, Isidora, ako hlúpo cirkevníci skresľovali aj svoje vlastné teórie... Tvrdili, že Katari neverili v Krista-človeka. Že katari údajne verili v jeho kozmickú Božskú podstatu, ktorá nebola hmotná. A zároveň cirkev hovorí, že Katari uznali Máriu Magdalénu za manželku Krista a prijali jej deti. Ako sa potom mohli narodiť deti nehmotnej bytosti?... Bez toho, aby sme, samozrejme, vzali do úvahy nezmysly o „nepoškvrnenom“ počatí Márie?... Nie, Isidora, na učení Katarov, žiaľ, nezostalo nič pravdivé. .. to, čo ľudia vedia, je úplne prevrátené „najsvätejšou“ cirkvou, aby sa toto učenie stalo hlúpym a bezcenným. Ale katari učili to, čo učili naši predkovia. Čo učíme. Ale pre duchovenstvo to bolo presne to najnebezpečnejšie. Nemohli dať ľuďom vedieť pravdu. Cirkev bola povinná zničiť čo i len tie najmenšie spomienky na Katarov, inak, ako by mohla vysvetliť, čo im urobila? .. AKO by po brutálnom a totálnom zničení celého národa vysvetlila svojim veriacim, prečo a kto potreboval taký hrozný zločin? Preto z učenia Kataru nezostalo nič ... A po storočiach si myslím, že to bude ešte horšie.
- A čo John? Niekde som čítal, že Katari údajne „verili“ v Jána? A dokonca, ako svätyňa, boli jeho rukopisy uchovávané... Je niečo z toho pravda?
„Jediné, že si Johna skutočne hlboko vážili, hoci ho nikdy nestretli. North sa usmial. - Nuž a tiež to, že po smrti Radomíra a Magdalény mali Katari skutočne skutočné Kristove „Zjavenia“ a Jánove denníky, ktoré sa rímska cirkev snažila za každú cenu nájsť a zničiť. Pápežovi služobníci sa zo všetkých síl snažili zistiť, kde tí prekliati Katari ukryli svoj najnebezpečnejší poklad?!. Pre, zjavte sa to všetko otvorene - a história katolícky kostol bol by úplne porazený. Ale bez ohľadu na to, ako veľmi sa cirkevní psi snažili, šťastie sa na nich nikdy neusmialo... Nič sa nepodarilo nájsť, okrem niekoľkých rukopisov očitých svedkov.
Preto jediným spôsobom, ako si cirkev v prípade Katarov ako-tak zachrániť povesť, bolo len prekrútiť ich vieru a učenie natoľko, že nikto na svete nerozoznal pravdu od lži... Ako ľahko to dokázali s život Radomíra a Magdalény.
Cirkev tiež tvrdila, že Katari uctievali Jána ešte viac ako samotného Ježiša Radomíra. Až teraz pod Jánom mysleli „svojho“ Jána s jeho falošnými kresťanskými evanjeliami a rovnakými falošnými rukopismi... Skutočný Ján z Catary bol skutočne poctený, ale ako viete, nemal nič spoločné s cirkvou. Ján - „krstiteľ“.
Kyselina rhodanová- bezfarebná, olejovitá, veľmi prchavá, silno zapáchajúca, ľahko tuhnúca kvapalina (t.t. 5 °C). V čistom stave je veľmi nestabilný a možno ho skladovať len pri nízkej teplote (zmes chladiva) alebo v zriedenom (menej ako 5 %) roztoku. Keď sa rozkladá, vzniká kyanovodík spolu so žltým pevným produktom, takzvanou kyselinou izopertiokyánovou H 2 C 2 N 2 S 3 .
Kyselina hydrotiánová je vo všetkých ohľadoch miešateľná s vodou. Jeho vodný roztok sa ľahko získa rozkladom tiokyanátu kyselinami alebo prechodom roztoku tiokyanátu amónneho cez katexové živice (napríklad levatit) vopred upravené HCl. V bezvodom stave sa táto zlúčenina získava miernym zahriatím suchého tiokyanátu ortuti alebo olovnatého v prúde sírovodíka:
Pb(SCN)2 + H2S -> PbS + 2HSCN
Tiokyanát vodíka je silná kyselina. Vo vodnom roztoku je podobne ako kyselina chlorovodíková takmer úplne alebo aspoň takmer úplne disociovaná.
Hydrotiokyanátové soli - tiokyanáty (tiokyanáty) sa ľahko získavajú z kyanidov pridaním síry. Autor: chemické vlastnosti silne pripomínajú chloridy. Podobne ako posledne menované tiokyanáty tvoria s dusičnanom strieborným zrazeninu nerozpustnú vo vode a zriedených kyselinách - tiokyanát strieborný AgSCN. Typickou a veľmi citlivou reakciou na tiokyanát je už vyššie spomínané červené sfarbenie, ktoré sa objavuje v dôsledku tvorby železitého tiokyanátu pri interakcii iónov Fe 3+ a SCN -. Samotné rodanové ióny sú bezfarebné, rovnako ako ich soli s bezfarebnými katiónmi. Väčšina tiokyanátov je vysoko rozpustná vo vode. Tiokyanáty striebra, ortuti, medi a zlata sú nerozpustné. Je ťažké rozpustiť tiokyanát olovnatý, ktorý sa rozkladá vo vriacej vode.
So stredne koncentrovanou (1:1) kyselinou sírovou sa tiokyanáty rozkladajú za uvoľňovania COS:
MSCN + 2H2S04 + H20 → COS + NH4HS04 + MHSO4
Niektoré tiokyanáty, ako aj ión SCN - v roztoku, viažu SO 2. Túto vlastnosť možno použiť na odstránenie SO 2 (a H 2 S) z plynov a výrobu čistého SO 2 .
Technická aplikácia tiokyanátu sa nachádza predovšetkým pri farbení látok. V technológii sa tiokyanát amónny NH 4 SCN získava hlavne pôsobením NH 3 vo vodnom roztoku na CS 2 pod tlakom pri teplote asi 110 ° C: 2NH 3 + CS 2 \u003d NH 4 SCN + H 2 S. Uvoľňovanie sírovodíka možno redukovať pridaním do reakčnej zmesi je hasené vápno H 2 S + Ca (OH) 2 → CaS + 2H 2 O. Tiokyanát amónny je bezfarebná soľ, ktorá kryštalizuje vo forme platní alebo hranolov so špecifickou hmotnosťou. 1,31 a teplotou topenia 159 °C. Veľmi ľahko a pri silnom chladení sa rozpúšťa vo vode. V 100 g vody pri 0 °C sa rozpustí 122, pri 20 °C - 162 g NH 4 SСN. Je tiež ľahko rozpustný v alkohole. V laboratóriách sa používa ako činidlo pre železité (III) soli a na stanovenie striebra Folgardovou metódou.
Tiokyanát draselný KSCN kryštalizuje ako bezfarebné hranoly so špecifickou hmotnosťou 1,9. Topí sa pri 161°C. Roztavená soľ pri 430 °C je sfarbená do modra a po ochladení opäť bezfarebná.
Vo vode sa rozpúšťa mimoriadne ľahko a pri silnom chladení.V 100 g vody pri 0 °C sa rozpustí 177, pri 20 °C - 217 a pri 25 °C - 239 g KSCN. Tiokyanát draselný vzniká fúziou kyanidu draselného so sírou alebo fúziou žltej krvnej soli s potašom a sírou. Nájde rovnaké uplatnenie ako tiokyanát amónny.
Tiokyanát sodný NaSCN sa veľmi ľahko rozplýva, ale zároveň kryštalizuje bez vody vo forme bezfarebných kosoštvorcových platní.
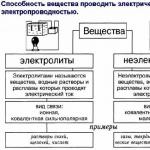
analytická skupina: СIˉ, Вгˉ, Iˉ, BrO3ˉ, CNˉ , SCNˉ-, S(2-)
Skupinovým činidlom pre anióny druhej analytickej skupiny je vodný roztok dusičnanu strieborného AgNO3 v zriedenej kyseline dusičnej (zvyčajne v 2 mol/l roztoku HNO3). V prítomnosti katiónov striebra tvoria anióny tejto skupiny zrazeniny strieborných solí, ktoré sú prakticky nerozpustné vo vode a v zriedenej kyseline dusičnej. pravda,
Sulfid strieborný Ag2S sa pri zahrievaní rozpúšťa v kyseline dusičnej. Všetky anióny druhej analytickej skupiny vo vodných roztokoch bezfarebný ich báryové soli sú rozpustné vo vode. Sulfidový ión S2- je silné redukčné činidlo (ľahko odfarbuje roztok jódu); chloridový ión CI ˉ bromidový ión Br ˉ jodidový ión I ˉ kyanidový ión CN ˉ , tiokyanátový ión (tiokyanátový ión) SCN ˉ (alebo NCS ˉ ) majú tiež redukčné vlastnosti, ale menej výrazné ako vlastnosti sulfidového iónu (napríklad odfarbujú roztok manganistanu draselného). Bromičnanový ión BrO3 v kyslom prostredí je účinným oxidačným činidlom.
Analytické reakcie chloridového iónu CIˉ.
Chloridový ión SG je anión silnej jednosýtnej kyseliny chlorovodíkovej (chlorovodíková, chlorovodíková) HCl.
Chloridové ióny SG tvoria s katiónmi striebra Ag+ biela syrová zrazenina chloridu strieborného AgCl:
CI ˉ + Ag+ -> AgCl↓
Zrazenina pri státí na svetle stmavne v dôsledku uvoľnenia jemne rozptýleného kovového striebra v dôsledku fotochemického rozkladu chloridu strieborného. Rozpúšťa sa v roztokoch amoniaku, uhličitanu amónneho, tiosíranu sodného za tvorby rozpustných komplexov striebra (I).
Metodológia. Do skúmavky sa pridajú 3-4 kvapky roztoku HCl, NaCl alebo KCI a po kvapkách sa pridáva roztok dusičnanu strieborného, kým sa nezastaví tvorba bielej zrazeniny chloridu strieborného.
Reakcia so silnými oxidačnými činidlami. Chloridové ióny sú oxidované silnými oxidačnými činidlami (zvyčajne v kyslom prostredí), napríklad manganistan draselný KMn04, oxid manganičitý Mn02, oxid olovnatý Pb02 atď., na molekulárny chlór C12:
2MnO4 ˉ +10СI ˉ + 16Н+ → 2Мn2+ + 5С12 + 8Н20
Mn02 + 2CH + 4H+ →C12 + Mn2+ + 2H20
Unikajúci plynný chlór je detekovaný modrou farbou vlhkého škrobového jodidového papiera v dôsledku tvorby molekulárneho jódu:
C12 + 2 I ˉ ->2CI ˉ +I2
Molekulárny jód poskytuje modrý molekulárny komplex so škrobom na škrobovom jodidovom papieri. Reduktory zasahujú, vrátane Br ˉ , ja ˉ tiež interagujú s oxidačnými činidlami.
Metodológia. Do skúmavky sa pridá 5-6 kvapiek roztoku HC1, NaCl alebo KC1, 5-6 kvapiek koncentrovaného roztoku KMn04 (alebo niekoľko kryštálov KMp04), 2-3 kvapky koncentrovanej kyseliny sírovej a zmes sa zahrieva ( určite pod tlakom!). Pôvodne vytvorený ružovofialový roztok sa postupne čiastočne alebo úplne odfarbí. Kvapka zmesi sa nanesie na papier s jodidom škrobu.
Na papieri je modrá škvrna. Môžete tiež bez nanesenia kvapky zmesi priviesť vlhký škrobový jodidový papier k otvoru skúmavky; papier zmodrie.
Niektoré ďalšie reakcie chloridových iónov. Chloridové ióny sa tvoria s dvojchrómanom draselným K2Cr2O7 v kyslom prostredí s prchavým chromylchloridom Cr02C12 (hnedá para). Sú známe aj iné reakcie chloridových iónov, ktoré sú menej analyticky zaujímavé.
Analytické reakcie bromidového iónu Brˉ. Bromidový ión Br- - anión silnej jednosýtnej kyseliny bromovodíkovej (bromovodíkovej) HBr.
Reakcia s dusičnanom strieborným (liekopis). Bromidové ióny tvoria žltkastú zrazeninu bromidu strieborného AgBr s katiónmi striebra:
Vg ˉ + Ag+ → AgBr↓
Zrazenina bromidu strieborného je prakticky nerozpustná vo vode, v kyseline dusičnej, v roztoku uhličitanu amónneho. Čiastočne rozpustný v koncentrovanom roztoku amoniaku (ale oveľa menej ako chlorid strieborný). Rozpúšťa sa v roztoku tiosíranu sodného za vzniku komplexu tiosíranu strieborného 3-:
AgBr+2S203(2-) ->3- + Br ˉ
Metodológia. Do skúmavky pridajte 3-4 kvapky roztoku NaBr alebo KBr a pridajte 4 -5 kvapiek roztoku AgNO3. Vyzráža sa svetložltá zrazenina bromidu strieborného.
Reakcia so silnými oxidačnými činidlami (liekopis). Silné oxidačné činidlá (KMp04, Mn02, KBr03, chlórnan sodný NaCIO, chlórová voda, chlóramín atď.) v kyslom prostredí oxidujú bromidové ióny na bróm, napr.
10Vr ˉ + 2MnO4 ˉ +16H+ ->5Br2 + 2Mn(2+) +8H20
2Br ˉ + С12 →Br2 + 2С1
5 Vg ˉ + Vg03 ˉ + 6Н+ → ЗВг2 + ЗН20 atď.
Vzniknutý molekulárny bróm, ktorý dáva vodnému roztoku žltohnedú farbu, možno z vodnej fázy extrahovať organickými rozpúšťadlami (chloroform, tetrachlórmetán, benzén atď.), v ktorých sa rozpúšťa viac ako vo vode. Organická vrstva sa zmení na žltohnedú alebo žltooranžovú. Molekulárny bróm možno detegovať aj reakciou s fuchsínovou kyselinou sírovou na filtračnom papieri (papier získa modrofialovú farbu) a tiež reakciou s fluoresceínom (červená farba). Reakcii bránia iné redukčné činidlá (sulfid, siričitan, tiosíran, ióny arzenitu atď.), ktoré tiež interagujú s oxidačnými činidlami. Keď sa bromidové ióny oxidujú veľkým prebytkom chlórovej vody, vytvorí sa žltý BrCl a roztok zožltne:
Br2+ Cl2 -> 2BrCl
Metodológia. Do skúmavky sa pridajú 3-4 kvapky roztoku NaBr alebo KBr, pridajú sa 2-3 kvapky roztoku H2SO4 a 4 -5 kvapiek chlórovej vody (alebo chlóramínu). Roztok pretrepte, pridajte 4 -5 kvapiek chloroformu a zmes znova pretrepte. Spodná organická vrstva sa zmení na tmavožltú, oranžovú alebo svetlohnedú. Farba vodnej fázy sa stáva svetložltou.
Analytické reakcie jodidového iónu G. Jodidový ión G je anión silnej jednosýtnej kyseliny jodovodíkovej (HI). Vo vodných roztokoch je jodidový ión bezfarebný, nehydrolyzuje a má výrazné redukčné vlastnosti, ako ligand tvorí stabilné jodidové komplexy s katiónmi mnohých kovov.
Reakcia s dusičnanom strieborným (liekopis). Jodidové ióny sa vyzrážajú katiónmi striebra z vodných roztokov vo forme svetložltej zrazeniny jodidu strieborného Agl:
ja ˉ + Ag +→ AgI↓
Zrazenina jodidu strieborného je prakticky nerozpustná vo vode, kyseline dusičnej a amoniaku. Rozpúšťa sa v roztokoch tiosíranu sodného a s veľkým nadbytkom jodidových iónov v roztoku.
Metodológia. Do skúmavky pridajte 3-4 kvapky roztoku KI, pridajte 4 -5 kvapiek roztoku AgNO3. Vyzráža sa svetložltá zrazenina jodidu strieborného.
Reakcia s oxidačnými činidlami (liekopis - s NaN02 a FeCl3 ako
oxidačné činidlá). Oxidačné činidlá (chlórová alebo brómová voda, KMn04, KBrO3, NaN02, FeCl3, H20 2 atď.) v kyslom prostredí oxidujú jodidové ióny I. ˉ na jód I2, napríklad:
2I ˉ + С12 →I2 + 2СГ
2I ˉ + 2Fe3+ →I2 + 2Fe2+
2I ˉ + 2NO2 ˉ + 4H+ →I2 + 2NO + 2H20
Najčastejšie sa používa chlórová voda. Uvoľnený jód sfarbí roztok do žltohneda. Molekulárny jód možno extrahovať z vodnej fázy chloroformom, benzénom a inými nemiešateľnými organickými rozpúšťadlami.
s vodou, v ktorej je molekulárny jód rozpustnejší ako vo vode. Organická vrstva sa zmení na fialovú a vodná vrstva sa zmení na svetlohnedú. Pri prebytku chlórovej vody sa výsledný jód ďalej oxiduje na bezfarebnú kyselinu jodovú HIO3 a roztok sa stáva bezfarebným:
I2 + 5С12 + 6Н20 → 2HIO3 + 10НCI
Redukčné činidlá interferujú s reakciou (S2-, S203(2-), SO3(2-)),
reaguje aj s oxidačnými činidlami.
Metóda (oxidácia jodidových iónov chlórovou vodou). Do skúmavky pridajte 2-3 kvapky roztoku KI a po kvapkách pridávajte chlórovú vodu, kým sa neuvoľní voľný jód. Potom pridajte 3-5 kvapiek chloroformu a zmes pretrepte. Organická vrstva sa zmení na purpurovú v dôsledku prenesenia jódu do nej z vodnej fázy. Za pretrepávania skúmavky sa opäť po kvapkách pridáva chlórová voda, kým sa roztok neodfarbí.
v dôsledku oxidácie jódu na bezfarebnú kyselinu jodovú.
Oxidačné reakcie bromidových a jodidových iónov slúži na otvorenie VR ˉ a ja ˉ v ich spoločnej prítomnosti. K tomu vodný roztok kyseliny sírovej obsahujúci anióny Br ˉ a ja ˉ pridajte chlórovú vodu a organické rozpúšťadlo, ktoré je nemiešateľné s vodou, schopné extrahovať bróm a jód z vodného roztoku (napríklad chloroform). Pri interakcii s chlórovou vodou sú ako prvé oxidované jodidové ióny I ˉ na jód I2. Organická vrstva sa sfarbí do fialova – tzv
otvorené jodidové ióny. Potom, keď sa pridá chlórová voda, jód sa oxiduje na HIO3 a
fialová farba organickej vrstvy zmizne. Bromidové ióny Br prítomné v roztoku ˉ oxidované chlórovou vodou na molekulárny bróm Br2, ktorý farbí organickú fázu už na oranžovo – takto sa otvárajú bromidové ióny. Ďalšie pridávanie chlórovej vody vedie k vytvoreniu žltého BrCl a organická vrstva zožltne.
Metodológia. Do skúmavky pridajte 2 kvapky roztoku NaBr alebo KBr, 2 kvapky roztoku KI, 5 kvapiek chloroformu a pomaly po kvapkách za potriasania skúmavkou pridávajte chlórovú vodu. Spočiatku sa tvorí jód a organická vrstva sa sfarbí do fialova, čo naznačuje prítomnosť jodidových iónov v počiatočnom vodnom roztoku. Pri ďalšom pridávaní chlórovej vody fialová farba organickej fázy zmizne.
(I2 sa oxiduje na HIO3) a stáva sa oranžovo-žltým (alebo hnedo-žltým) v dôsledku rozpusteného molekulárneho brómu, čo naznačuje prítomnosť bromidových iónov v počiatočnom vodnom roztoku. Pridanie nadbytku chlórovej vody vedie k zmene farby organickej fázy na žltú v dôsledku tvorby BrCl.
Reakcia jódového škrobu. Molekulový jód, ktorý vzniká pri oxidácii jodidových iónov rôznymi oxidačnými činidlami, sa často objavuje reakciou so škrobom, ktorý s jódom (presnejšie s trijodidovými iónmi I) vytvára modrý komplex. Prítomnosť jódu sa posudzuje podľa vzhľadu modrej farby.
Metodológia.
a) do skúmavky sa pridajú 3-4 kvapky roztoku KI, kvapka roztoku HC1, 2-3 kvapky roztoku oxidačného činidla - KN02 alebo NaN02 a pridá sa kvapka čerstvo pripravené vodný roztok škrobu. Zmes sa zmení na modrú.
b) Na filtračnom papieri impregnovanom čerstvo pripravenéškrobový roztok, aplikujte kvapku roztoku oxidačného činidla - NaN02 alebo KN02 a kvapku okysleného roztoku KI. Papier je zafarbený na modro.
Reakcia so soľami olova. Jodidové ióny sa tvoria s olovnatými katiónmi Pb2+žltá zrazenina jodidu olovnatého PY2:
2I ˉ + Pb2 + →PY2
Pri zahrievaní sa zrazenina rozpustí vo vode. Po ochladení roztoku sa uvoľňuje jodid olovnatý vo forme krásnych zlatých šupinatých kryštálov (reakcia zlatého dažďa).
Iné reakcie jodidových iónov. Jodidové ióny vstupujú do mnohých reakcií s rôznymi činidlami. Napríklad so soľami medi (II) tvoria hnedú zrazeninu (zmes jodidu meďnatého Cul a jódu I2), so soľami ortuti (II) - červená zrazenina jodidu ortutnatého HgI2, s ortuťou ( I) soli - zrazenina jodidu ortutnatého (I) Hg2I2 zelená, so soľami bizmu-
ta(III) - čiernohnedá zrazenina jodidu bizmutitého Bil3 atď.
Analytické reakcie tiokyanátového iónu (tiokyanátového iónu) SCNˉ.
Tiokyanátový ión (alebo tiokyanátový ión), označovaný ekvivalentnými vzorcami SCN ˉ alebo NCS ˉ , anión silného tiokyanátu
HSCN. Tiokyanátový ión vo vodných roztokoch je bezfarebný, nehydrolyzuje, má
redoxnými vlastnosťami, so soľami rôznych
kovy tvoria stabilné tiokyanátové komplexy.
Reakcia s dusičnanom strieborným Tiokyanátový ión pri interakcii s katiónmi striebra vytvára bielu syrovú zrazeninu tiokyanatanu strieborného AgCSN:
SCN ˉ + Ag+ -> AgSCN
Zrazenina je nerozpustná v minerálnych kyselinách a v roztoku uhličitanu amónneho. Rozpúšťa sa vo vodnom amoniaku, v roztokoch tiosíranu sodného, kyanidu draselného, s nadbytkom tiokyanátových iónov za vzniku zodpovedajúcich rozpustných komplexov striebra:
AgSCN + 2NH3 →+ + SCN' ˉ
AgSCN+ nS203(2-)→ (1-2n) + SCN ˉ (n=2 a 3)
AgSCN+2CN ˉ "->ˉ +SCN ˉ
AgSCN+ (n-1)SCN ˉ →(1-n) (u = 3 a 4)
Metodológia. Do skúmavky sa pridajú 2-3 kvapky roztoku tiokyanátu draselného KSCN alebo tiokyanátu amónneho NH4SCN a po kvapkách sa pridáva roztok AgNO3, kým sa nevyzráža biela zrazenina tiokyanátu strieborného. Pokračujte v pridávaní roztoku KSCN alebo NH4SCN po kvapkách za pretrepávania skúmavky, kým sa zrazenina tiokyanátu strieborného nerozpustí.
Reakcia so soľami kobaltu (II). Tiokyanátové ióny v prítomnosti katiónov kobaltu (II) tvoria modré tetratiokyanatokobaltátové (II) ióny 2-, ktoré farbia roztok na modro:
4NCS ˉ +Co2+ ↔ 2-
Tieto komplexy však nie sú dostatočne silné, s nie príliš veľkým prebytkom iónov NCS ˉ rovnováha sa posunie doľava a roztok sa zmení na ružový a nie modrý (farba kobaltových aquo komplexov). Na posunutie rovnováhy doprava sa reakcia uskutočňuje vo vodnom acetónovom prostredí alebo sa komplex extrahuje organickými rozpúšťadlami, v ktorých sa rozpúšťa lepšie ako vo vode (napríklad v zmesi izoamylalkoholu a dietyléteru).
Reakcia so soľami trojmocného železa. Tiokyanátové ióny sa tvoria s železitými katiónmi v kyslom (na potlačenie hydrolýzy železitého) prostredí tiokyanátové železité komplexy červeného zloženia
(3-n), kde P= 1, 2,..., 6. Všetky trojmocné trojmocné komplexy s rôznym obsahom tiokyanátových skupín sú sfarbené do červena av roztoku sú vo vzájomnej rovnováhe. Pri zvýšených koncentráciách iónov NCS ˉ v riešení dominujú komplexy s veľkou hodnotou n, pri nízkej - s nižšou hodnotou P. Výsledné komplexy je možné extrahovať organickými rozpúšťadlami - dietyléterom, amylalkoholom atď.
Toto. Môže sa vykonávať kvapkacou metódou na filtračný papier. Interferujú rôzne anióny - S2-, SO3 (2-), S203 (2-), C2O4 (2-), I ˉ , NO2 ˉ atď.
Metodológia. Na filtračný papier sa nanesie kvapka roztoku KNCS alebo NH+NCS a nádoba s roztokom železitej soli. Papier je zafarbený na červeno.
Reakcia s iónmi jodičnanu. V kyslom prostredí sú tiokyanátové ióny oxidované iónmi jodičnanu za uvoľnenia voľného jódu:
5SCN ˉ +6IO3 ˉ +N + +2H20 -> 5S04(2-) +5HCN+3I2
Tejto reakcii však bránia redukčné anióny, ktoré reagujú aj s iónmi jodičnanu. Pretože reakcia produkuje vysoko toxický kyanovodík
potom kyselina HCN mal by sa vykonávať iba pri ťahu!
Metodológia. Navlhčite filtračný papier čerstvo pripravenéškrobový roztok a vysuší sa. prijímať škrob papier, na ktorý sa nanesie kvapka zriedeného roztoku HC1, kvapka roztoku KSCN a kvapka roztoku jodičnanu draselného KIO3. Papier sa zmení na modrý v dôsledku tvorby modrého molekulárneho komplexu škrobu s jódom uvoľneným počas reakcie.
Niektoré ďalšie reakcie tiokyanátových iónov. Tiokyanátové ióny sa rozkladajú pomocou roztokov H2SO4, HN03 a silných oxidačných činidiel, vstupujú do mnohých reakcií tvorby komplexov, zrážania, redoxných a iných reakcií. Napríklad s dusičnanom ortutnatým Hg(N03)2 tvoria bielu zrazeninu tiokyanátu ortutnatého Hg(SCN)2, ktorý je rozpustný s nadbytkom iónov SCN-; s katiónmi Cu2+ -
rozpustné komplexy smaragdovozelenej farby alebo (s nadbytkom katiónov Cu2+) čierna zrazenina tiokyanátu meďnatého Cu (SCN) 2, ktorá sa zahrievaním mení na biely tiokyanát meďnatý CuSCN - atď.
Získanie tiokyanátov
Hlavnými metódami na získanie HNCS sú interakcia (E)NCS s KHS04 alebo iónová výmena vodných roztokov NH4 NCS (získaného zahrievaním zmesi amoniaku a sírouhlíka). Rhodan alebo tiokyan sa zvyčajne získava reakciami:
Cu(SCN) 2 = CuSCN + 0,5 (SCN) 2
Hg(SCN)2 + Br2 = HgBr2 + (SCN)2
Tiokyanáty alkalických kovov a amónne sa získavajú zachytávaním kyanidových zlúčenín obsiahnutých v koksárenskom plyne pomocou roztokov zodpovedajúcich polysulfidov. Okrem toho sa NH4 NCS vyrába reakciou NH3 s CS2 a KNCS a NaNCS sa vyrábajú fúziou KCN alebo NaCN so sírou.
KCN + S = KSCN(fúzia)
Iné tiokyanáty sa syntetizujú výmennou reakciou síranov, dusičnanov alebo halogenidov kovov s tiokyanátom Ba, K alebo Na:
KSCN + AgNO 3 = AgSCN + KNO 3
alebo reakciou hydroxidov alebo uhličitanov kovov s HNCS:
HSCN + NaOH = NaSCN + H20
CuSCN sa získavajú z tiokyanátov alkalických kovov, hydrosiričitanu sodného a síranu meďnatého. Ca(SCN) 2 * 3H 2 O sa získava pôsobením oxidu vápenatého na tiokyanatan amónny.
Komplexné zlúčeniny tiokyanátov
Tiokyanáty tvoria komplexné zlúčeniny, v ktorých môže byť kov v závislosti od donorovo-akceptorových vlastností ligandu koordinovaný tak na atóme dusíka, ako aj na atóme S.
Hg(HH) tvorí trigonálne komplexy tiokyanatanu ortutnatého s pnitrobenzoylhydrazínom (L). Interakcia zodpovedajúceho Hg(SCN)2 s pnitrobenzoylhydrazínom a fúzia pri teplote 50-60 °C poskytli HgL(SCN)2. Experimentálne sa zistilo, že táto látka je nerozpustná vo väčšine organických rozpúšťadiel, mierne rozpustná v MeCN a ich roztoky nie sú elektrolyty. Ukazuje sa spektrum HgL(SCN)2 C-N pruhy, C-S a C-S, čo naznačuje kruhovú povahu skupiny SCN a jej koordináciu s Hg 2+ cez atóm S. Na základe skutočnosti, že ligand L je monodentantný a skupina SCN je kruhová, dospelo sa k záveru, že neutrálny Hg (SCN)2 má monomérnu trojkoordinačnú štruktúru.
Použitie tiokyanátov
Tiokyanáty sa používajú v priemysle. NH 4 SCN sa používa pri galvanickom pokovovaní, fotografovaní, farbení a potlači tkanín (najmä na zachovanie vlastností hodvábnych tkanín), na prípravu chladiacich zmesí, na výrobu kyanidov a hexakyanoželezitanov (II), tiomočoviny, guanidínu, plasty, lepidlá, herbicídy.
NaSCN sa používa vo fotografii, ako moridlo pri farbení a potlači textílií, v medicíne, ako laboratórne činidlo, pri galvanickom pokovovaní, pri príprave umelého horčičného oleja a v gumárenskom priemysle.
KSCN sa používa v textilnom priemysle, v organickej syntéze (napríklad na získanie tiomočoviny, umelého horčičného oleja alebo farbív), na získanie tiokyanátov, chladiacich zmesí, insekticídov.
Ca(SCN) 2 *3H 2 O sa používa ako moridlo na farbenie alebo potlač látok a ako rozpúšťadlo na celulózu, na mercerizáciu bavlny, v medicíne namiesto jodidu draselného (na liečbu aterosklerózy), na výrobu hexakyanoželezitanov ( II) alebo iných tiokyanátov pri výrobe pergamenu.
CuSCN sa používa ako moridlo pri tlači na textil, pri výrobe námorných farieb a v organickej syntéze; Cu(SCN) 2 sa používa na výrobu detonačných kapsúl a zápaliek. Používajú sa tiež v analytickej chémii ako činidlá v rodanometrii a ortuti.
Tiokyanátové komplexy sa používajú vo fotometrickej analýze na stanovenie Co, Fe, Bi, Mo, W, Re, v technológii vzácnych kovov na oddelenie Zr a Hf, Th a Ti, Ga a Al, Ta a Nb, Th a La, aby sa získali spektrálne čisté La. Tiokyanáty Nb(V) a Ta(V) sú katalyzátormi Friedel-Craftsovej reakcie.
2.5. Tiokyanát (tiokyanát) ortuť (YY)
Hg(SCN) 2 je jedovatý biely kryštalický prášok bez zápachu. Dobre sa rozpúšťa v horúca voda. Zle rozpustný v studená voda(0,07 g v 100 g pri 25 °C) a v akýchkoľvek esteroch. Rozpustný aj v roztokoch amónnych solí, v alkohole a v KSCN, v kyselina chlorovodíková, ako aj v roztokoch tiokyanátov s tvorbou komplexný ión. Na vzduchu je stabilný, no pri dlhodobom skladovaní uvoľňuje tiokyanátové ióny. Vznikové teplo tiokyanátu ortutnatého (HJ) DH 0 arr. \u003d 231,6 kJ / mol a teplota rozkladu je T0 rozklad. = 165 °C.
Odkaz na históriu
Ako prvý dostal tiokyanát ortuťnatý (II) mladý nemecký vedec Friedrich Wöller, ktorý sa neskôr zaslúžil o objav kyseliny tiokyanovej.
Jedného dňa na jeseň roku 1820 Friedrich Wöller, veľmi mladý študent medicíny na univerzite v Heidelbergu, zmiešaním vodných roztokov tiokyanatanu amónneho NH 4 NCS a dusičnanu ortutnatého Hg (NO 3) 2 zistil, že biela zrazenina neznámej látka vyzrážaná z roztoku. Wöller roztok prefiltroval a usušil zrazeninu, z izolovanej hmoty urobil „klobásu“, vysušil ju a potom pre zaujímavosť zapálil. „Klobása“ sa vznietila a stal sa zázrak: vyliezol dlhý čierno-žltý „had“ a vyrástol z neopísateľnej bielej hrudky, krútil sa a rástol. Ako sa neskôr ukázalo, Wöller ako prvý získal tiokyanát ortutnatý Hg(NCS) 2 . Zo začiatku sa experiment nazýval Wöllerov tiokyanátový „had“ a až potom ho začali nazývať „faraónov had“.
Získanie Hg(SCN)2
Hg(SCN) 2 vzniká interakciou KSCN so soľou Hg(JJ):
Hg (NO 3 ) 2 +2KSCN = Hg(SCN) 2 v+2KNO 3
Alebo Hg (NO 3 ) 2 + 2NH 4 NCS = Hg (NCS) 2 v + 2NH 4 NIE 3
Druhá reakcia je exotermická.
Reakcie charakteristické pre Hg(NCS)2
Hg (NCS) 2 sa rozpúšťa v roztoku tiokyanátu draselného za vzniku komplexnej zlúčeniny tetratiokyanomerkurátu (YI) draselného (biele ihličkovité kryštály, ľahko rozpustné v studenej vode, v alkohole, menej rozpustné v akýchkoľvek éteroch):
Hg (NCS) 2 + 2KSCN \u003d K 2
Tiokyanát ortutnatý sa po zapálení rýchlo rozkladá za vzniku čierneho sulfidu ortutnatého HgS, žltého objemného nitridu uhlíka zloženia C 3 N 4 a sírouhlíka CS 2, ktorý sa na vzduchu zapáli a horí za vzniku oxidu uhličitého CO 2 a oxid siričitý SO 2:
2Hg (NCS) 2 = 2 HgS + C 3 N 4 +CS 2
CS2 + 302 = C02 + 2S02
Nitrid uhlíka napučiava so vzniknutými plynmi, pričom pri pohybe zachytáva čierny sulfid ortutnatý (II) a získa sa žltočierna porézna hmota. Modrý plameň, z ktorého sa „had“ plazí, je plameň horiaceho sírouhlíka CS 2 .
Aplikácia
Tiokyanát ortutnatý (II) sa používa v analytickej chémii na stanovenie kobaltu, halogenidov, kyanidov, sulfidov a tiosíranov, na spektrofotometrické merania koncentrácie chloridu kyseliny izokaprónovej vo výrobe. Je to komplexotvorné činidlo. Používa sa v anorganickej syntéze. Používa sa vo fotografii na zvýraznenie negatívu. Zaujímavé pre laboratórnu prácu.
Toxikologické aspekty
Tiokyanáty majú škodlivý účinok všetkým živým organizmom. Preto sa v procese práce s nimi treba vyhnúť kontaktu so sliznicami, očami a pokožkou.
Keď malé množstvá tiokyanátov vstupujú do tela dlhší čas, tieto majú tyreostatický účinok. Môže sa vyvinúť struma a dystrofické procesy v rôznych orgánoch.
Príznaky akútnej otravy sú dýchavičnosť, sipot, zhoršená koordinácia pohybov, zovretie zreníc, kŕče, hnačka, skoky v krvnom tlaku, poruchy srdca a duševné poruchy.
V prípade akútnej otravy je potrebné zastaviť kontakt postihnutého s látkou. Obeť potrebuje teplo, odpočinok a protijedovú terapiu (dusitany, aminofenoly, tiosírany, organické zlúčeniny kobaltu).