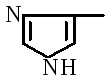
Bir protein molekülünde amino asitleri bağlama yolları
Proteinin ana yapısal birimi a-amino asitlerdir.
İlk kez, 1888'de A.Ya. Danilevsky, bir protein molekülündeki amino asitlerin -COOH ve -NH2 gruplarıyla bağlandığını ve daha sonra peptit bağları olarak adlandırılan bağlar oluşturduğunu belirledi. Birinci amino asidin karboksil grubunun, ikinci amino asidin a-karbonundaki amino grubuyla etkileşimi ile bir peptit bağı oluşur. Bu durumda, bir su molekülü ayrılır: örneğin, iki alanin molekülünden bir alanil-alanin dipeptidi oluşur:
İki amino asitten oluşan bir bileşiğe dipeptit, üç amino asitten birine tripeptit vb. denir. Bağ – CO- NH- peptit bağı denir.
Amino asit kalıntılarının sayısı ise 10 dan fazla, sonra aradı polipeptid, 50'nin üzerinde–proteinler. Ayırt etmek N-son, serbest bir -NH 2 grubunun olduğu ve C-terminali peptit, burada amino asidin serbest -COOH grubu. Bir peptit bağı oluşumunda rol oynayan -COOH ve -NH2 gruplarına ek olarak, amino asitler protein molekülünün yan dallarında bulunan başka fonksiyonel grupları da içerir:
|
aspartik ve glutamik asitler |
|
|
lisin, oksilisin, |
|
|
|
arginin guanidil grubu |
|
|
histidin imidazol grubu |
|
serin ve treonin |
|
|
|
tirozinin fenolik grubu |
|
sisteinin sülfhidril grubu |
|
|
metiyonin tioeter grubu |
|
|
fenilalanin benzen halkası |
|
|
diğer amino asitlerin alifatik zincirleri, vb. |
Amino asit moleküllerinde peptit bağının oluşumunda yer almayan bir grup atoma amino asit radikalleri denir. Radikal iyonlu amino asitler vardır. Bu grup, negatif veya pozitif yüklü radikallere sahip 7 amino asit içerir. "-" yüklü aspartik ve glutamik asitler, tirozin ve sistein de "-" yükü taşıyabilir; lizin, arginin ve histidin "+" yük taşır.
Polar radikallerde seri ve treonin (-OH) bulunur. Buna asparagin, glutamin de dahildir. Üçüncü amino asit grubu polar olmayan alifatik veya aromatik radikallere (alanin, valin, lösin, izolösin, metionin, fenilalanin, triptofan, prolin, hidroksiprolin) sahiptir. Dolayısıyla bir protein molekülünün yapısının oluşturulmasında peptit bağı oluşumuna ek olarak amino asit radikallerinin özellikleri de önemlidir.
peptitler - 5000 daltona kadar (50 amino asit kalıntısı) Mm'ye sahip, yarı geçirgen bir zardan geçer. Doğada, ayırt ettikleri hayvan ve insan vücudu dahil olmak üzere 200'den fazla peptit bilinmektedir:
1. Peptitler-hormonlar: vazopressin, oksitosin, kortikotropin, glukagon, kalsitonin, melanostimüle edici hormon.
2. Sindirime dahil olan peptitler - gastrin, sekretin - toplam 12 peptit.
Z. Anjiyotensin (vazokonstriktör), bradikinin.
4. Nöropeptitler.
b. Hayvanları çeşitli enfeksiyonlara karşı dirençli kılan ve geniş bir antimikrobiyal aktivite spektrumuna sahip olan düşük moleküler ağırlıklı (Mm 4 kDa) peptitler.
Sentez yoluyla elde edilen peptitler vardır. Örneğin, FMD'ye karşı sentetik bir peptit aşısı, 16 amino asit kalıntısından türetilir. Redoks enziminin protein olmayan kısmı bir tripeptittir: glutatyondur (y-glutamil-sisteinil-glisin):
karnosin: β-alanil-histidin ve anserin-metil-karnosin dipeptitlerdir: kas kasılmalarını arttırırlar, antioksidan ve membran stabilize edici özelliklere sahiptirler. Glisin ve prolinden gelen peptitler kanın pıhtılaşmasını etkiler, mide mukozasını korur ve beyni etkiler. Endotelin peptitleri vasküler tonu düzenler.
dipeptit aspartam(asparagin + fenilalanin) yöntemi ile elde edilir. genetik mühendisliği. Şekerden 300 kat daha tatlıdır, içeceklere şeker yerine eklenir (Coca-Cola).
Protein molekülünün 4 yapısı vardır.
Bir proteinin birincil yapısı - bu, peptit zincirindeki amino asit kalıntılarının dizisidir (değişim). Peptit bağları, kısmen disülfid bağları bu yapının oluşumuna katılır. Birincil yapı genlerde kodlanmıştır, kalan protein organizasyonu seviyelerini belirler. İnsülin proteininin birincil yapısı ilk olarak Sanger (1953) tarafından belirlenmiştir. Artık çok sayıda proteinin birincil yapısı incelenmiştir. Örneğin, insülin molekülü iki kısımdan oluşur: A-21, B-30 amino asit kalıntıları.
Yapısı aşağıdaki gibi temsil edilebilir:
 asp. COOH A zinciri (21 amino asit kalıntısı)
asp. COOH A zinciri (21 amino asit kalıntısı)
COOH Zincirde (30 amino asit kalıntısı)
A ve B zincirleri arasında ve A zinciri içinde disülfid bağları oluşur. 124 amino asit kalıntısından oluşan bir RNazın birincil yapısı Şekil 2'de gösterilmektedir. 2.2.
Hemoglobinin birincil yapısının incelenmesi, orak aneminin (Şekil 2.3.) - bir kan hastalığı - 146 amino asit kalıntısının B zincirindeki sadece tek bir amino asidin değiştirilmesinden kaynaklandığını belirlemeyi mümkün kılmıştır.
N-terminalinden 6-pozisyonunda glutamik asit yerine valin varsa, bu tür hemoglobin oksijen taşıma işlevini yerine getirmez:
4 5 6 7 - amino asitlerin konumu
Tre - pro - glu - liz - norm
Tre - pro - şaft - liz - patoloji
Bir proteinin ikincil yapısı sarmal bir konfigürasyonda bir polipeptit zinciri döşemenin bir yoludur. Bu döşeme, birincil yapıda ortaya konan programa göre gerçekleşir.

Şekil 2.2. RNaz'ın birincil yapısı. Dört disülfid bağı renkli olarak vurgulanmıştır.

Şekil 2.3 Normal ve orak şekilli eritrositler
Pauling ve Corey, küresel proteinlerin amino asit radikalleri arasındaki hidrojen bağları nedeniyle bir a-sarmal oluşturduğunu buldu. Oksijen ve hidrojen, nitrojen ve hidrojen atomları arasında bir radikalin karbonil grubu ve başka bir radikalin amin grubu nedeniyle bir hidrojen bağı oluşur:
Karbonil grubu ve NH grubu, birbirleriyle bir hidrojen bağı oluşturabilir. Peptit grubunun oksijen ve hidrojen atomları trans pozisyonunu işgal eder ve - CH etrafında serbest dönüş mümkündür:
![]()
Sonuç olarak, hidrojen bağlarının oluşumu, peptidin spesifik şeklini belirler. Peptit zincirlerinin üç tip ikincil yapısı vardır: a-sarmal, β yapısı (katlanmış katman), rastgele bobin.
Bir α-sarmal, saat yönünde bir bobindir (Şekil 2.4).
Her tur 3,6 amino asit 5,4 A (1 amino asit başına 1,5 A) içerir, her 5 turda (18 amino asit kalıntısı) yapısal konfigürasyon tekrarlanır, fibriller proteinlerin a-sarmal bir yapısı vardır - keratinler saç, yün, cilt, burada -S-S- bağları yüksek mukavemet verir.
Katlanmış katmanda (β-yapı) peptit zincirleri, bir akordeon veya yaprak şekli oluşturarak bir katmanda birbirine paralel olarak düzenlenir. Katman, iki veya daha fazla peptit tarafından oluşturulabilir.
Etki Alanları ikincil bir yapıyı temsil eder (Şekil 2.5).
Bir hidrojen bağı sadece karbonil grubu (negatif oksijen yükü) ile başka bir polipeptit zincirinin imino grubunun \u003d NH'sinin hidrojen atomu arasında değil, aynı zamanda iki hidroksil grubu arasında da oluşabilir.
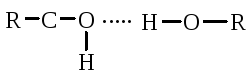
ve serin ve tirozinin hidroksil grubu.
ikincil yapı kolajen. Vücuttaki kolajen miktarı, toplam protein miktarının 1/3'üdür (tendonlar, bağlar, eklem kapsülleri vb.).
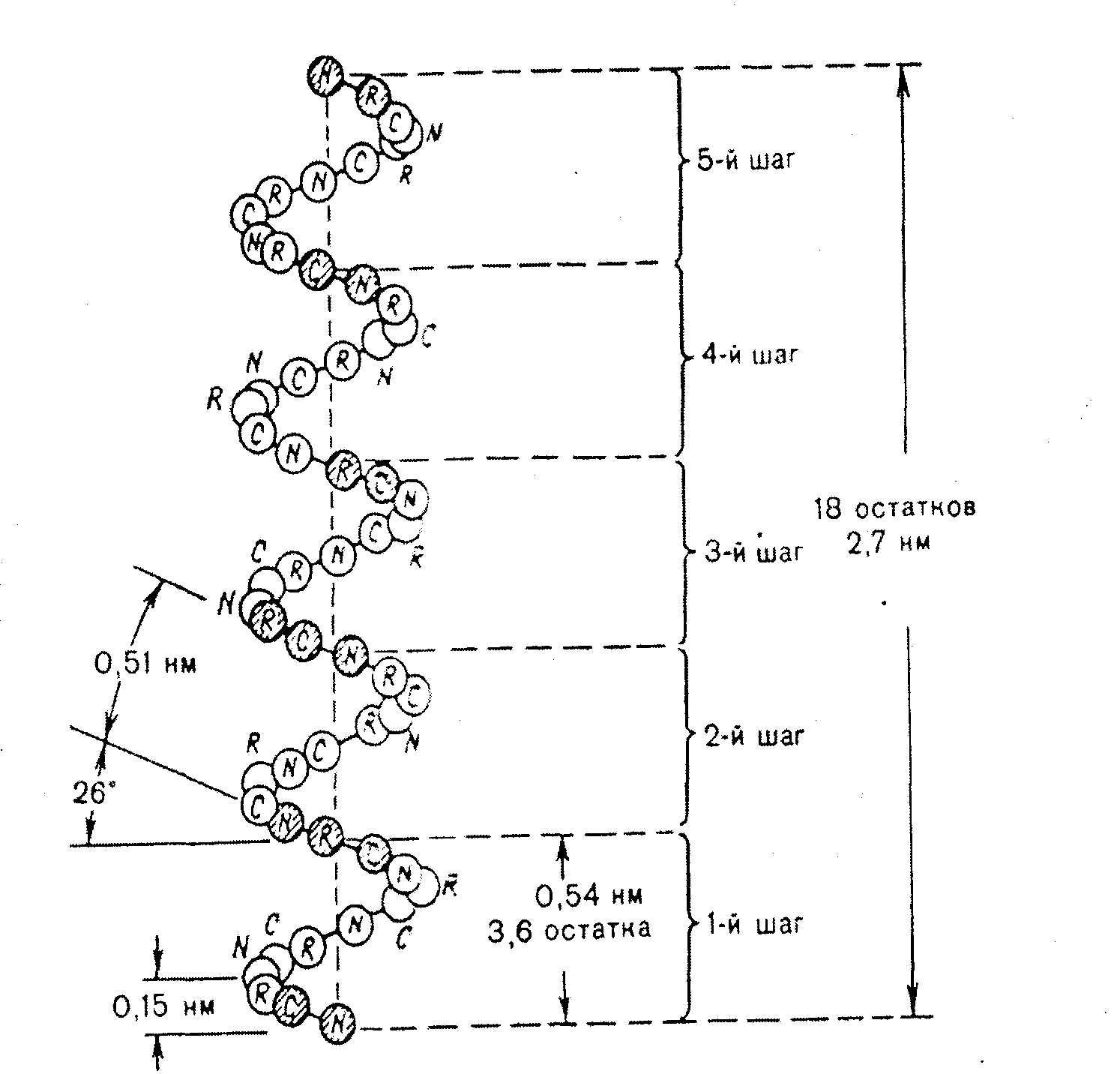
Pirinç. 2.4. α sarmalının yapısı ve parametreleri.
Keratinlerin α sarmalının aksine, kolajenin gerilmesi zordur. Kollajen çok fazla glisin içerir - toplam amino asit kalıntısının 1/3'ü, 1/4 veya daha fazlası prolin ve hidroksiprolindir. Bu amino asitler, polipeptit zincirlerinin bir a-sarmal oluşturma yeteneğini bozar. Kollajende her 3 polipeptit zinciri bükülür ve üçlü bir sarmal oluşturur.
üçüncül yapı sincap. Bu, polipeptit sarmalının uzaysal oryantasyonu veya polipeptit zincirinin belirli bir hacimde döşenme şeklidir.
Üçüncül yapısı İngiliz J. Kendrew tarafından açıklanan ilk protein. Bu sperm balina miyoglobinidir, moleküler ağırlığı 16700 Da, 153 amino asit kalıntısı içerir. Bir polipeptit zincirine sahiptir. Polipeptit zinciri, heme (demir içeren protein olmayan bileşen) etrafına kompakt bir şekilde yerleştirilmiş kavisli bir tüp şeklinde sunulur.
Günümüzde X-ışını kırınım analizinin etkinliğinin artması sayesinde birçok proteinin üçüncül yapısı deşifre edilmiştir.

Katlanmış katman Etki Alanları
Pirinç. 2.5. Katlanmış katman ve etki alanlarının şeması.
Üçüncül yapıyı stabilize eden bazı bağ türleri Şekil 2.6'da gösterilmiştir. peptit
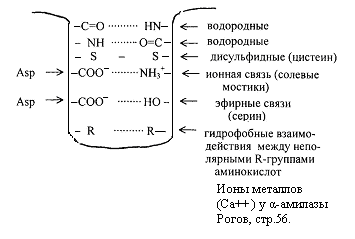
Şekil 2.6. İkincil ve üçüncül yapıyı stabilize eden bağlar.
Üçüncül yapı, peptit ve disülfid bağları tarafından sağlanır, ancak asıl rol kovalent olmayan bağlar - hidrojen, moleküller arası Van der Waals-Londra kuvvetleri, hidrofobik etkileşimler vb.
Bir proteinin üçüncül yapısı, ribozomlarda sentezinin tamamlanmasından sonra otomatik olarak meydana gelir. Birincil yapı tarafından belirlenir - polipeptit zincirindeki amino asit kalıntılarının dizisi. Üçüncül yapı, protein molekülünün (katalitik, hormonal, antijenik, vb.) biyolojik aktivitesi ile ilişkilidir. Hidrojen bağlarının ve diğer bazı bağların kırılmasına yol açan ve böylece molekülün doğal konformasyonunu tahrip eden herhangi bir fiziksel ve kimyasal etkiye, biyolojik özelliklerinin proteininin kısmen veya tamamen kaybı eşlik eder (Şekil 2.7). ).
Kuaterner yapı sincap. Bu, aynı (veya farklı) birincil, ikincil ve üçüncül yapıya sahip bireysel polipeptit zincirlerinin uzayda döşenmesi ve tek bir makromoleküler oluşumun oluşumudur. Her bir polipeptit zinciri (protomer) çoğu zaman biyolojik aktiviteye sahip değildir. Biyolojik bir molekül, bu yeteneği, kurucu protomerlerinin belirli bir uzaysal ilişkilendirme yolu ile kazanır, böylece bir multimer oluşturur.
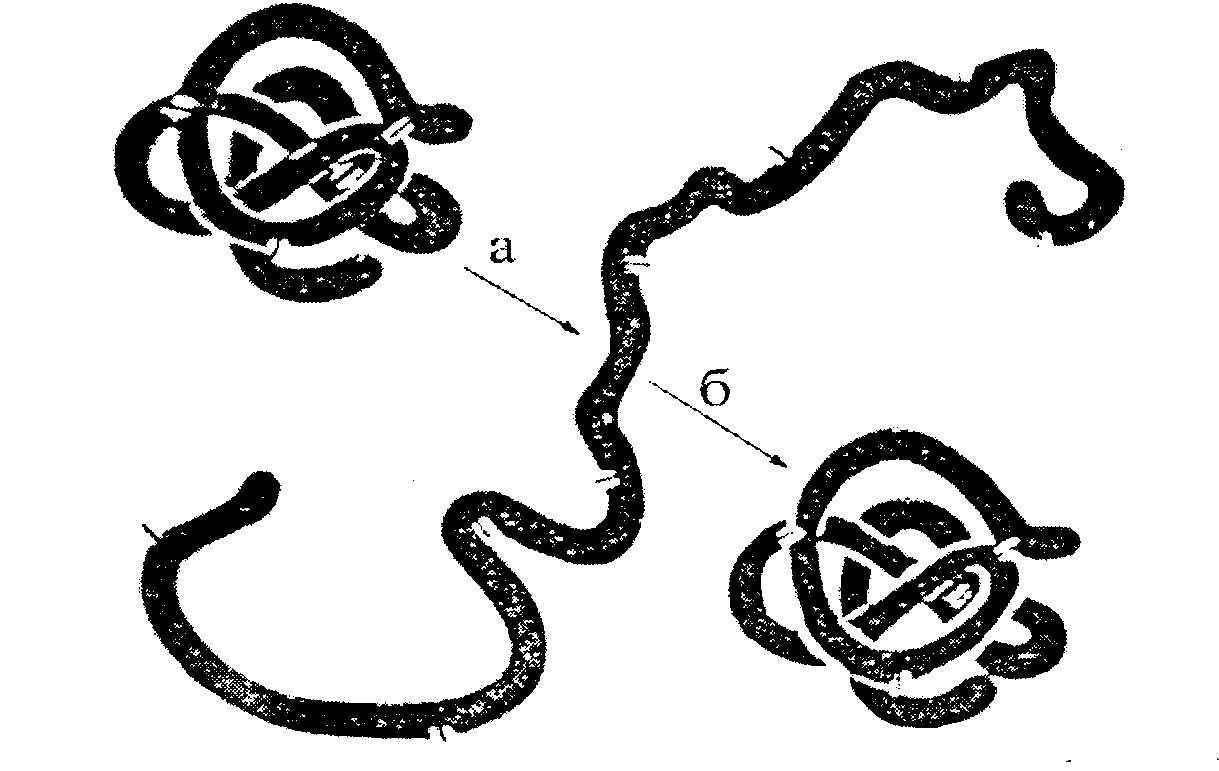
Şekil 2.7. Ribonükleazın denatürasyonu ve renatürasyonu (Anfinsen'e göre).
a - yerleştirme (üre + merkaptoetanol);
b - yeniden katlama
Örneğin, hemoglobin molekülü, her biri iki polipeptit zincirinden oluşan α- ve β-alt birimlerinden oluşur. 4 polipeptidin her biri, bir demirli demir atomu içeren bir hem grubunu çevreler. Belirli koşullar altında tuzların, ürenin, pH'daki değişikliklerin, moleküllerin varlığında; hemoglobin, hidrojen bağlarının kırılmasıyla ilişkili olan 2 α- ve 2 β-zincirine geri dönüşümlü olarak ayrışır. Tuzların, ürenin uzaklaştırılmasından sonra, pH değiştiğinde, orijinal molekül otomatik olarak geri yüklenir (Şekil 2.8).
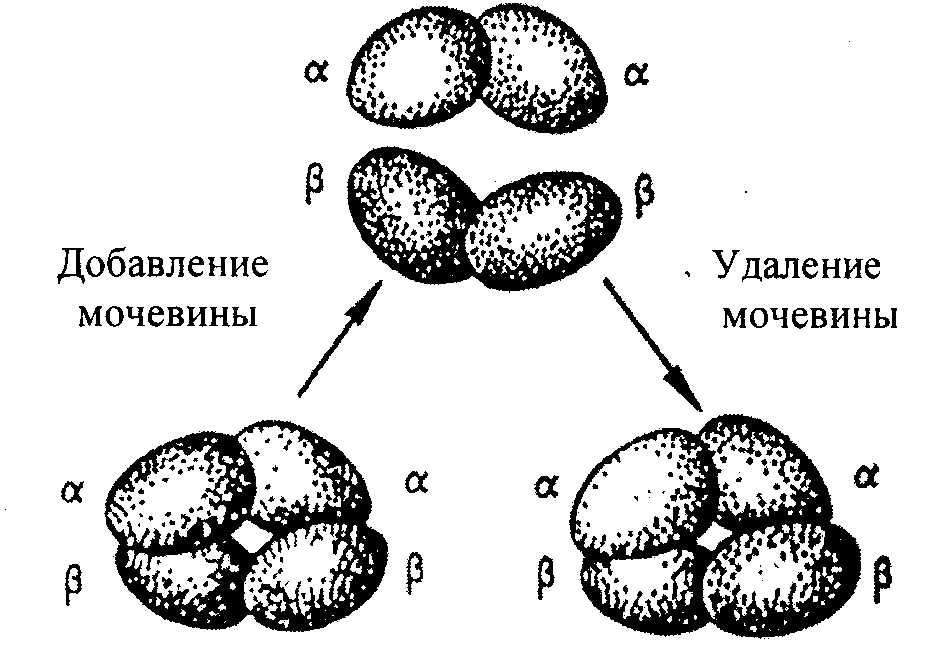
Şekil 2.8. Hemoglobin molekülünün geri dönüşümlü ayrışması.
Tütün mozaik virüsü proteini yaklaşık 40 x 10 b Da moleküler ağırlığa sahip dev bir moleküle sahiptir, virüs 1 RNA molekülünden ve her biri 17500 Da moleküler ağırlığa sahip 2130 protein alt biriminden oluşur. RNA'nın etrafında, 130 dönüşü olan sarmal bir yapı oluşturan protein alt birimleri bulunur. Deterjanların eklenmesinden sonra RNA çıkarılabilir; en şaşırtıcı olan şey, deterjanların çıkarılmasından sonra virüs partikülünün otomatik olarak tekrar toplanabilir olmasıdır. Aynı zamanda virüsün biyolojik özellikleri, enfektivite, antijenik aktivite vb. de geri yüklenir. (Şek. 2.9.).
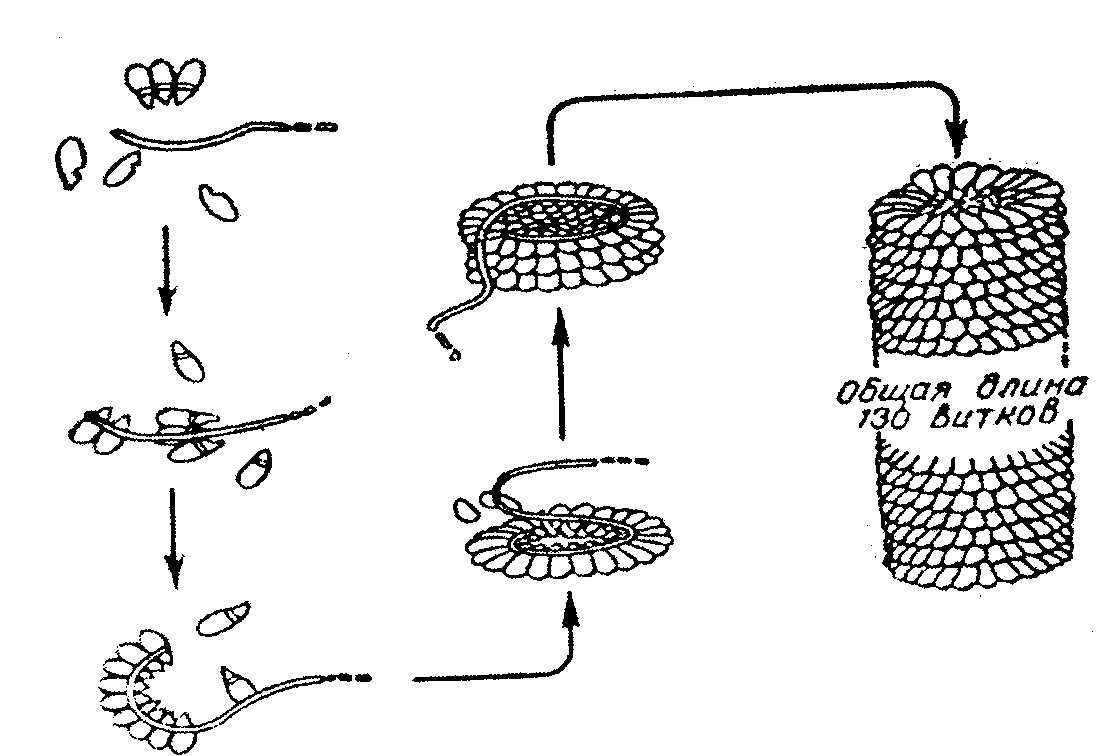
Pirinç. 2.9. Tütün mozaik virüsünün kendi kendine toplanması.
Mikrotübüller tüm hücrelerde bulunur. Sürekli olarak parçalanırlar, sonra yeniden oluşurlar, hücre bölünmesi sırasında kromozomların hareketinde, maddelerin hücre içi taşınmasında yer alırlar. Mm 111500 Da ile iki peptitten oluşan tübülinden yapılmıştır. Hücrelerden izole edilebilirler; Mg 2+ mikrotübüllerin etkisi altında oluşur.
Ribozomlar, hücre zarları da karşılıklı istiflenen ve dörtlü bir yapı oluşturan birkaç polipeptitten (protomer) oluşur.
80'lerin ortalarında, hücrede, ana işlevi polipeptit zincirlerinin doğal bir yapıya katlanmasının doğru yapısını sağlamak olan özel bir protein kategorisi olduğu keşfedildi. Bu proteinlere "moleküler şaperonlar" denir. Birbirinin altında yedi üyeli iki halka halinde düzenlenmiş polipeptitlerden oluşurlar. Bu şekilde oluşturulan silindirin merkezinde bir boşluk vardır - polipeptit zincirinin katlanmasının meydana geldiği bir kanal (çapı 45 angstrom). Ek olarak, foldaz enzimleri, disülfid bağlarının oluşumunu ve bazı stabil trans-peptidil-prolil bağlarının fonksiyonel aktivite için gerekli cis konfigürasyonuna izomerik dönüşümlerini katalize ederek, protein molekülünün katlanmasında yer alır.
Merhaba sevgili okuyucularım. Aranızdayım Galina Baeva ve bugün protein moleküllerinin yapısı ve fonksiyonları hakkında konuşacağız.
Bu protein neden gerekli? Onsuz yapabilir miyiz?
Hayır, yapmayacağız. Diyalektik materyalizmin sakallı kurucusu Friedrich Engels şöyle demiştir: Yaşam, protein cisimlerinin varoluşunun bir yoludur. Başka bir deyişle, protein hayattır, protein yoktur - ne yazık ki, ah. Normalde, protein 50%, şunlar. hücrenin kuru kütlesinin yarısı ve insan vücudunun kuru kütlesinden 45% .
Proteinlerin yapısal özellikleri göstermelerine izin verir. çeşitli özellikler onların çeşitli biyolojik fonksiyonlarını ne belirler?
Proteinlere başka türlü protein denir, bunlar bir ve aynıdır.
Proteinler vücutta ne yapar?
- Proteinler vücudumuzun yapı taşlarıdır. Hücre zarlarının (lipoproteinler, glikoproteinler) ve hücre dışı yapıların yapısal elemanlarıdır. Kollajen tendonları oluşturur, cildin esnekliğinden de sorumludur, keratin saç ve tırnakları oluşturur.
- Proteinler vücut boyunca gerekli elementleri taşır. Hemoglobin, akciğerlerden tüm organ ve dokulara oksijen taşır ve onlardan karbondioksiti alır, albümin proteini yağ asitlerini ve özel proteinler kolesterolü taşır. Hücre zarları, belirli madde ve iyonların hücreden hücre dışı boşluğa ve hücre dışına taşınmasını sağlayan proteinler içerir.
- Hormonlar - metabolik süreçleri düzenleyen özel maddeler - protein niteliğindedir. Örneğin, insülin hormonu, şekeri kan plazmasından hücrelere taşır.
- Proteinler vücudu yabancı maddelerden korur. Gama globulinler mikropları nötralize eder, interferonlar virüslerin üremesini baskılar. Fibrin kanamayı durdurur.
- Proteinler, motor kasların ve diğer kasılan dokuların kasılmasını sağlar. Aktin ve miyozin, vücudun kaslarının, troponin, tropomiyosin - kalbin kaslarının bir parçasıdır.
- Proteinler dış ortamdan sinyaller alır ve hücreye komutlar iletir. Çevresel faktörlerin etkisi altında, sinyal proteinleri üçüncül yapılarını değiştirir ve bu da bir biyokimyasal süreç zincirini tetikler. Rodopsin ışığa bu şekilde tepki verir, ışık enerjisini elektrik enerjisine dönüştürür ve bu da sinir hücreleri aracılığıyla görsel bir görüntünün oluştuğu beyne iletilir.
- Proteinler enzimlerdir - katalizörler, bu nedenle biyokimyasal reaksiyonların meydana gelmesinin mümkün olduğu durumlarda Düşük sıcaklık(37 0 C).
- Proteinler - düzenleyiciler hücre genlerini açar ve kapatır, böylece biyokimyasal süreçleri baskılar veya aktive eder.
- Proteinler, kural olarak, yumurta albümini ve süt kazeini hariç, vücutta birikmez. Vücutta ekstra protein yoktur. Ancak diğer maddeler ve eser elementlerle birleşerek vücuttan atılmalarını engelleyebilirler. Böylece ferritin, hemoglobinin parçalanması sırasında salınan demir ile bir kompleks oluşturur ve onu biyolojik süreçlere yeniden dahil eder.
- Proteinler enerji sağlayabilir. 1 gr proteinin parçalanması ile 4 kcal (17,6 kJ) açığa çıkar. Bir enerji kaynağı olarak proteinler, diğer normatif kaynaklar - karbonhidratlar ve yağlar - tükendiğinde kullanılır. D.I. Mendeleev'in sözleriyle, proteinlerle boğulmanın banknotlarla boğulmaya benzediğini söyleyebiliriz, vücut için çok değerlidirler.
Yaşam molekülü nedir?
Bu uzun bir zincirdir, yani. monomerlerden oluşan polimer - amino asitler. Neden amino asitler? Çünkü her molekülün bir C-O-OH organik asit kuyruğu ve bir NH2 amino grubu vardır. Polimer zincirinde, her amino asit monomeri, asit kalıntısını başka bir monomerin amino grubuna bağlar ve bu da güçlü bir bağ ile sonuçlanır. peptit.
Protein ve peptit kavramları birbirine yakındır, ancak eşdeğer değildir. Peptitler genellikle belirli bir amino asit kalıntıları dizisi olarak adlandırılır. Oligopeptitler izole edilir - 10-15 amino asitlik kısa zincirler ve polipeptitler - uzun amino asit dizileri zincirleri. Bir protein, özel bir uzamsal organizasyon biçimine sahip bir polipeptittir.

Amino asitleri bir kolyeye boncuk gibi dizerek, bir proteinin birincil yapısışunlar. amino asit kalıntıları dizisi.\
Uzayda, protein uzun bir iplik şeklinde değil, spiral şeklinde kıvrılır, yani. şekiller ikincil yapı.

Spiral bir top haline gelir - bir küre, bu zaten proteinin üçüncül yapısı.
Bazı proteinler (hepsi değil) Kuaterner yapı, her biri kendi birincil, ikincil ve üçüncül yapısına sahip birkaç molekülü bileşiminde birleştirir.
Neden bilmen gerekiyor? Proteinin sindirimi ve asimilasyonu doğrudan yapısına bağlı olduğundan: protein gıda ürününün bileşiminde ne kadar yoğun olursa, sindirimi o kadar zor olur, asimilasyonu için o kadar fazla enerji harcanması gerekir.
Bir protein molekülündeki bağların parçalanmasına ne ad verilir? denatürasyon. Protein yapıyı eski haline getirdiğinde denatürasyon tersine çevrilebilir ve geri döndürülemez. Proteinler, yüksek sıcaklıklara maruz kaldıklarında da dahil olmak üzere geri dönüşü olmayan denatürasyona uğrarlar - bir kişi için 42 0 C'nin üzerindedir, bu nedenle ateş hayatı tehdit eder.
Et veya balık pişirdiğimizde, sütü kaynattığımızda, yumurtaları kızarttığımızda veya kaynattığımızda, tahılları kaynattığımızda ve ekmek pişirdiğimizde, pişirme işlemi sırasında proteinleri kontrollü denatürasyona tabi tutuyoruz. Hafif sıcaklığa maruz kalma ile, bağları kopmuş proteinler, sindirim enzimleri için daha erişilebilir hale gelir ve vücut tarafından daha iyi emilir. Uzun süreli ve sert sıcaklığa maruz kalma ile - kömürde kızartma, uzun süreli pişirme - sindirilemeyen bileşiklerin oluşumu ile proteinin ikincil denatürasyonu meydana gelir.
Amino asitler
İki yüzden fazla farklı amino asit vardır, ancak proteinlerin - polimerlerin bileşiminde sürekli olarak sadece yirmi bulunur. Bu 20 "sihirli" amino asit, iki eşit olmayan gruba ayrılır: esansiyel olmayan, yani. vücudun kendisi tarafından üretilebilen ve yeri doldurulamaz (temel) olanlar, insan vücudu tarafından üretilmezler ve onları mutlaka gıda ile elde etmeliyiz.
Esansiyel olmayan amino asitler şunları içerir: Alanin, Arginin, Aspargin, Aspartik asit, Glisin, Glutamin, Glutamik asit, Prolin, Serin, Tirozin, Sistin.
Esansiyel amino asitler: Valin, İzolösin, Lösin, Lisin, Metionin, Trionin, Triptofan, Fenilalanin
Çocuklar için esansiyel amino asitler Arginin ve Histidin'dir.
Amino asitler ayrı bir yazı olacak.
Protein sınıflandırması
Tam bir protein, bileşiminde gerekli tüm amino asitleri içerir ve buna göre eksik bir protein, herhangi bir amino asit içermez.
Tüm vücut proteinlerinin yapımı için sadece tüm amino asitlerin varlığı değil, aynı zamanda gıda ürünündeki oranları da önemlidir. Amino asit bileşiminde insan vücudunun proteinlerine en yakın gıda optimaldir. Bir amino asit eksikse, diğer amino asitler vücut tarafından kullanılamaz, ayrıca eksikliği gidermek için kendi proteinleri, başta proteinler - biyosentez süreçlerinde yer alan enzimler ve kas proteinleri parçalanmaya başlar. Bir veya daha fazla esansiyel amino asidin eksikliği koşulları altında, bu fazlalık göreceli olmasına rağmen, diğer amino asitler aşırı hale gelir. Çürüyen kas proteinleri oldukça toksik metabolik ürünler oluşturur ve vücut tarafından yoğun bir şekilde atılır. negatif nitrojen dengesi. Bir kişi, beslenmesinde her şeyin yolunda olduğuna içtenlikle inanabilmesine rağmen, zayıflamaya başlar.
Proteinler kökenlerine göre hayvansal ve bitkisel olarak ikiye ayrılır.
Hayvansal proteinler, yumurta, süt ve süt ürünleri, balık ve deniz ürünleri, hayvan ve kuş etlerinin proteinlerini içerir.
Bitkisel proteinler, tahıllar, baklagiller, kuruyemişler ve mantarlardan elde edilen proteinleri içerir.
En az %15 protein içeren yiyecekler protein olarak kabul edilir.
Tüm hayvansal proteinler eksiksizdir, yani. tam bir amino asit seti içerir. Çoğu bitki proteini eksiktir.
Gıdalardan yetersiz protein alımı ile vücutta gerekli işlevleri yerine getirememe ile ilişkili dejeneratif süreçler gelişir. Her şeyden önce, bağışıklık acı çekiyor. Bir kişi viral ve bakteriyel enfeksiyonlara yatkın hale gelir, hastalıklar uzar, kronikleşir. Saç dökülmeye başlar, cilt gevşer, kırışır. İstemli alan acı çeker, ilgisizlik bir kişiyi kapsar, hiçbir şey yapma isteksizliği, depresyon katılır. azalır kas kütlesi metabolizma yavaşlar. Sindirim sorunları sözde başlar. "irritabl bağırsak sendromu", yemek yemeye şişkinlik eşlik ettiğinde, ishalin yerini kabızlık alır ve bunun tersi de geçerlidir. Kadınlarda üreme fonksiyonu baskılanır, adet kanaması durur. Ağır vakalarda organlarda ve dokularda yapısal değişiklikler başlar, gözle görülür tükenme. Çocuklarda protein açlığı aşağıdakilere yol açar: zeka geriliği.
Ülkemizi dahil ettiğimiz medeni ülkelerde, tüberküloz veya onkoloji gibi hastalıkları dışlarsak, zamanımızda şiddetli protein açlığı, çılgınca açlık diyetleri yapan kişilerde, manik bir kilo verme arzusuyla ortaya çıkar.
Son mesaj Angelina Jolie ile ilgiliydi, 35 kg ağırlığında hastaneye kaldırıldı - Nazi toplama kampı mahkumlarının Sovyet kurtarıcıları bu şekilde buldu. Canlı iskeletlerin güzellik örnekleri olması pek olası değildir.
Bununla birlikte, protein ürünlerinin göreceli olarak yüksek maliyeti nedeniyle gelişen sağlıksız bir beslenme düzeni nedeniyle, protein eksikliği çok nadir görülen bir durum değildir. Para biriktirmek için insanlar, kusurlu bitkisel protein tüketimi ile karbonhidrat-yağ diyetine geçerler. Taşıyıcılardan ve protein olmayan ürünlerden yapılan yarı mamul ürünler katkı sağlar. Yani hazır pirzola, sosis, sosis satın alan bir kişi, yeterince protein tükettiğine içtenlikle inanabilir. Hata yapma.
Bir sonraki makalede, bir kişinin sağlıklı kalması için ne kadar ve ne tür proteine ihtiyacı olduğunu öğreneceksiniz.
Yorum bırakın, bilgileri paylaşın sosyal ağlarda. Galina Bayeva.
Proteinler, vücudun herhangi bir canlı hücresinin önemli organik elementlerinden biridir. Pek çok işlevi yerine getirirler: destekleme, sinyal verme, enzimatik, taşıma, yapısal, reseptör vb. Birincil, ikincil, üçüncül ve dördüncül yapılar bu moleküllerin önemli evrimsel uyarlamaları haline mi geldi? Vücut hücrelerindeki proteinlerin doğru yapısı neden bu kadar önemlidir?
Proteinlerin yapısal bileşenleri
Herhangi bir polipeptit zincirinin monomerleri amino asitlerdir (AA). Bu düşük moleküler ağırlıklı organik bileşikler, doğada oldukça yaygındır ve kendi işlevlerini yerine getiren bağımsız moleküller olarak var olabilirler. Bunlar arasında maddelerin taşınması, alınması, enzimlerin inhibisyonu veya aktivasyonu bulunur.
Toplamda yaklaşık 200 biyojenik amino asit vardır, ancak bunlardan sadece 20'si protein monomeri olabilir. Suda kolayca çözünürler, kristal bir yapıya sahiptirler ve birçoğunun tadı tatlıdır.
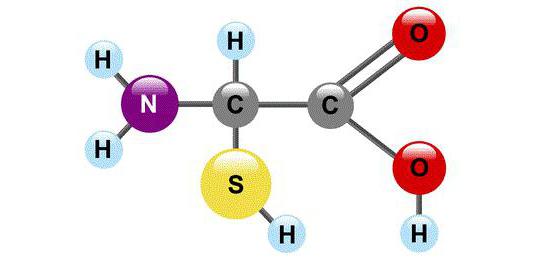
Kimyasal bir bakış açısından AA, mutlaka iki fonksiyonel grup içeren moleküllerdir: -COOH ve -NH2. Bu grupların yardımıyla amino asitler, bir peptit bağı ile birbirine bağlanan zincirler oluşturur.
20 proteinojenik amino asidin her biri, hangisine bağlı olarak kendi radikaline sahiptir. Kimyasal özellikler. Bu tür radikallerin bileşimine göre, tüm AA'lar birkaç gruba ayrılır.
- Polar olmayan: izolösin, glisin, lösin, valin, prolin, alanin.
- Polar ve yüksüz: treonin, metionin, sistein, serin, glutamin, asparagin.
- Aromatik: tirozin, fenilalanin, triptofan.
- Polar ve negatif yüklü: glutamat, aspartat.
- Polar ve pozitif yüklü: arginin, histidin, lisin.
Protein yapısının herhangi bir organizasyonu (birincil, ikincil, üçüncül, dördüncül), AA'dan oluşan bir polipeptit zincirine dayanır. Tek fark, bu dizinin uzayda nasıl oluştuğu ve hangi kimyasal bağların yardımıyla böyle bir konformasyonun muhafaza edildiğidir.
Bir proteinin birincil yapısı
Herhangi bir protein, polipeptit zincirinin sentezinde yer alan zar olmayan hücre organelleri olan ribozomlarda oluşur. Burada amino asitler, birincil bir yapı oluşturan güçlü bir peptit bağı kullanılarak birbirine bağlanır. Bununla birlikte, bir proteinin böyle bir birincil yapısı, kuaterner olandan son derece farklıdır, bu nedenle molekülün daha fazla olgunlaşması gereklidir.
Zaten bu kadar basit bir yapıya sahip olan elastin, histonlar, glutatyon gibi proteinler vücutta işlevlerini yerine getirebilmektedir. Proteinlerin büyük çoğunluğu için bir sonraki adım, daha karmaşık bir ikincil konformasyonun oluşumudur.

Bir proteinin ikincil yapısı
Peptit bağlarının oluşumu, çoğu proteinin olgunlaşmasının ilk adımıdır. İşlevlerini yerine getirebilmeleri için yerel yapılarının bazı değişikliklere uğraması gerekir. Bu, hidrojen bağlarının yardımıyla elde edilir - kırılgan, ancak aynı zamanda amino asit moleküllerinin bazik ve asit merkezleri arasında çok sayıda bağlantı.
Konfigürasyonun basitliği ve lokal konformasyon açısından dörtlüden farklı olan proteinin ikincil yapısı bu şekilde oluşur. İkincisi, tüm zincirin dönüşüme tabi olmadığı anlamına gelir. Hidrojen bağları birbirinden farklı uzaklıklarda birkaç yerde oluşturulabilir ve bunların şekli amino asitlerin tipine ve montaj yöntemine de bağlıdır.
Lizozim ve pepsin, ikincil bir yapıya sahip proteinlerin temsilcileridir. Pepsin, sindirim süreçlerinde yer alır ve lizozim vücutta koruyucu bir işlev görür ve bakterilerin hücre duvarlarını yok eder.
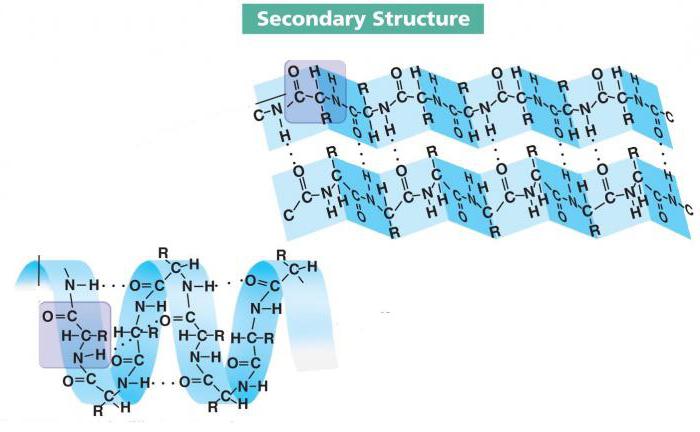
İkincil yapının özellikleri
Peptid zincirinin lokal konformasyonları birbirinden farklı olabilir. Birkaç düzine zaten incelenmiştir ve bunlardan üçü en yaygın olanıdır. Bunlar arasında alfa sarmalı, beta katmanları ve beta dönüşü vardır.
- Alfa sarmalı, çoğu proteinin en yaygın ikincil yapı biçimlerinden biridir. 0,54 nm stroklu sert bir çubuk çerçevedir. Amino asit radikalleri dışa doğru yönlendirilir.
Sağ elini kullanan spiraller en yaygın olanıdır ve bazen solak meslektaşları bulunabilir. Şekillendirme işlevi, bukleleri stabilize eden hidrojen bağları tarafından gerçekleştirilir. Alfa sarmalını oluşturan zincir çok az prolin ve polar yüklü amino asitler içerir.
- Beta dönüşü ayrı bir konformasyonda izole edilmiştir, ancak buna beta sayfasının bir parçası denilebilir. Sonuç olarak, hidrojen bağları tarafından desteklenen peptit zincirinin bükülmesidir. Genellikle bükümün yeri, prolin varlığının zorunlu olduğu 4-5 amino asitten oluşur. Bu AK, bir dönüş oluşturmanıza izin veren sert ve kısa bir iskelete sahip olan tek AK'dir.
- Beta katmanı, birkaç kat oluşturan ve bunları hidrojen bağlarıyla stabilize eden bir amino asit zinciridir. Bu biçim, bir akordeon şeklinde katlanmış bir kağıda çok benzer. Çoğu zaman, agresif proteinler bu forma sahiptir, ancak birçok istisna vardır.
Paralel ve antiparalel beta katmanları vardır. İlk durumda, kıvrımlardaki ve zincirin uçlarındaki C- ve N- uçları çakışır, ancak ikinci durumda olmazlar.
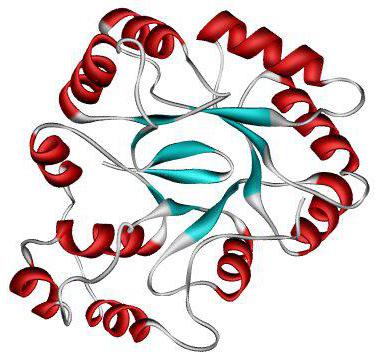
üçüncül yapı
Proteinin daha fazla paketlenmesi, üçüncül bir yapının oluşumuna yol açar. Bu konformasyon hidrojen, disülfid, hidrofobik ve iyonik bağlar yardımıyla stabilize edilir. Çok sayıda olmaları, ikincil yapının daha karmaşık bir şekle bükülmesine ve stabilize edilmesine izin verir.
Küresel ve küresel peptitlerle ayrılırlar.Küresel peptitlerin molekülü küresel bir yapıdır. Örnekler: albümin, globulin, üçüncül yapıdaki histonlar.
Uzunluğu genişliklerini aşan güçlü teller oluşur. Bu tür proteinler çoğunlukla yapısal ve şekillendirme işlevlerini yerine getirir. Örnekler fibroin, keratin, kollajen, elastindir.
Molekülün kuaterner yapısındaki proteinlerin yapısı
Birkaç globül tek bir kompleks halinde birleşirse, sözde kuaterner yapı oluşur. Bu konformasyon tüm peptitlerin özelliği değildir ve önemli ve spesifik işlevlerin yerine getirilmesi gerektiğinde oluşur.
Bileşimdeki her globül ayrı bir alan veya protomerdir. Toplu olarak, moleküller bir oligomer olarak adlandırılır.
Tipik olarak, böyle bir protein, bazı dış faktörlerin etkisine bağlı olarak veya çeşitli işlevlerin yerine getirilmesi gerektiğinde sürekli olarak birbirinin yerini alan birkaç kararlı yapıya sahiptir.
Bir proteinin üçüncül ve dördüncül yapısı arasındaki önemli bir fark, birkaç globülün bağlanmasından sorumlu olan moleküller arası bağlardır. Tüm molekülün merkezinde, genellikle moleküller arası bağların oluşumunu doğrudan etkileyen bir metal iyonu bulunur.
Ek protein yapıları
Bir proteinin işlevlerini yerine getirmek için her zaman bir amino asit zinciri yeterli değildir. Çoğu durumda, bu tür moleküllere organik ve inorganik nitelikteki diğer maddeler eklenir. Bu özellik, enzimlerin büyük çoğunluğunun özelliği olduğundan, kompleks proteinlerin bileşimi genellikle üç kısma ayrılır:
- Bir apoenzim, bir amino asit dizisi olan bir molekülün protein parçasıdır.
- Koenzim bir protein değil, organik bir kısımdır. Çeşitli lipit türlerini, karbonhidratları ve hatta nükleik asitleri içerebilir. Bu, aralarında vitaminlerin bulunduğu biyolojik olarak aktif bileşiklerin temsilcilerini içerir.
- kofaktör - vakaların büyük çoğunluğunda metal iyonları ile temsil edilen inorganik bir kısım.
Bir molekülün kuaterner yapısındaki proteinlerin yapısı, farklı kökenli birkaç molekülün katılımını gerektirir, bu nedenle birçok enzimin aynı anda üç bileşeni vardır. Bir örnek, bir ATP molekülünden bir fosfat grubunun transferini sağlayan bir enzim olan fosfokinazdır.
Bir protein molekülünün kuaterner yapısı nerede oluşur?
Polipeptit zinciri hücrenin ribozomlarında sentezlenmeye başlar, ancak diğer organellerde proteinin daha da olgunlaşması gerçekleşir. Yeni oluşan molekül, nükleer zar, ER, Golgi aygıtı ve lizozomlardan oluşan taşıma sistemine girmelidir.
Proteinin uzamsal yapısının komplikasyonu, sadece endoplazmik retikulumda meydana gelir. Farklı çeşit bağlar (hidrojen, disülfid, hidrofobik, moleküller arası, iyonik), ancak bir koenzim ve bir kofaktör de katılır. Proteinin kuaterner yapısı bu şekilde oluşur.
Molekül tamamen çalışmaya hazır olduğunda, ya hücrenin sitoplazmasına ya da Golgi aygıtına girer. İkinci durumda, bu peptitler lizozomlarda paketlenir ve hücrenin diğer bölümlerine taşınır.
oligomerik protein örnekleri
Kuaterner yapı, canlı bir organizmada hayati fonksiyonların performansına katkıda bulunmak için tasarlanmış proteinlerin yapısıdır. Organik moleküllerin karmaşık yapısı, her şeyden önce, birçok metabolik sürecin (enzimler) çalışmasını etkilemeyi mümkün kılar.
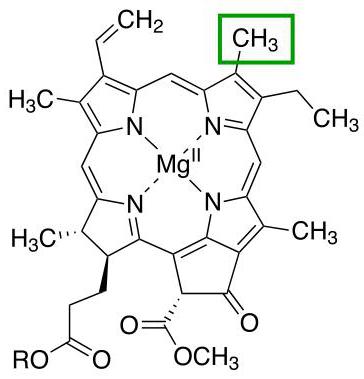
Biyolojik olarak önemli proteinler hemoglobin, klorofil ve hemosiyanindir. Porfirin halkası, merkezinde bir metal iyonu olan bu moleküllerin temelidir.
Hemoglobin
Hemoglobin protein molekülünün kuaterner yapısı, moleküller arası bağlarla birbirine bağlanan 4 globülden oluşur. Merkezde demir iyonu olan bir porfin var. Protein, sitoplazmanın toplam hacminin yaklaşık %80'ini işgal ettikleri eritrositlerin sitoplazmasında taşınır.
Molekülün temeli, daha inorganik bir yapıya sahip olan ve kırmızı renkli olan heme'dir. Aynı zamanda karaciğerdeki hemoglobinin birincil yıkım ürünüdür.
Hemoglobinin önemli bir taşıma işlevi gördüğünü hepimiz biliyoruz - insan vücudu boyunca oksijen ve karbondioksit transferi. Bir protein molekülünün karmaşık yapısı, karşılık gelen gazları hemoglobine bağlayabilen özel aktif merkezler oluşturur.
Bir protein-gaz kompleksi oluştuğunda, sözde oksihemoglobin ve karbohemoglobin oluşur. Bununla birlikte, bu tür ilişkilerin oldukça kararlı olan başka bir türü daha vardır: karboksihemoglobin. Kararlılığı aşırı toksisite ile boğulma saldırılarını açıklayan bir protein ve karbon monoksit kompleksidir.

Klorofil
Alan bağları zaten bir magnezyum iyonu tarafından desteklenen, kuaterner bir yapıya sahip proteinlerin bir başka temsilcisi. Tüm molekülün ana işlevi, bitkilerde fotosentez süreçlerine katılmaktır.
Porfirin halkasının radikalleri ile birbirinden farklı olan farklı klorofil türleri vardır. Bu çeşitlerin her biri, Latin alfabesinin ayrı bir harfiyle işaretlenmiştir. Örneğin, kara bitkileri, klorofil a veya klorofil b'nin varlığı ile karakterize edilirken, alglerde bu proteinin başka türleri de bulunur.
hemosiyanin
Bu molekül, birçok alt hayvanda (eklem bacaklılar, yumuşakçalar, vb.) hemoglobinin bir analoğudur. Kuaterner moleküler yapıya sahip bir proteinin yapısındaki temel fark, demir iyonu yerine çinko iyonunun varlığıdır. Hemosiyanin mavimsi bir renge sahiptir.
Bazen insanlar, insan hemoglobinini hemosiyanin ile değiştirirsek ne olacağını merak ediyor. Bu durumda, kandaki maddelerin ve özellikle amino asitlerin olağan içeriği bozulur. Ayrıca hemosiyanin, karbondioksit ile bir kompleks oluşturacak şekilde kararsızdır, bu nedenle "mavi kan" kan pıhtıları oluşturma eğiliminde olacaktır.
4 milyar yıldan fazla bir süre önce, Dünya'da küçük inorganik moleküllerden, canlı organizmaların yapı taşları haline gelen proteinler anlaşılmaz bir şekilde ortaya çıktı. Tüm canlılar sonsuz çeşitliliklerini tam olarak benzersiz protein moleküllerine borçludur ve Evrendeki diğer yaşam formları bilim tarafından hala bilinmemektedir.
Proteinler veya proteinler (Yunanca "protos" - "ilk" den), herhangi bir organizmanın tüm yaşam süreçlerini sağlayan doğal organik bileşiklerdir. Gözün ve ağın merceği, kaplumbağa kabuğu ve zehirli maddeler mantarlar... Proteinlerin yardımıyla yiyecekleri sindirir ve hastalıklarla savaşırız. Özel proteinler sayesinde ateş böcekleri geceleri parlar ve okyanusun derinliklerinde denizanası gizemli bir ışıkla parlar.
Canlı bir hücrede diğerlerinden kat kat daha fazla protein molekülü vardır (tabii ki su hariç!). Bilim adamları, çoğu organizmada proteinlerin kuru kütlelerinin yarısından fazlasını oluşturduğunu bulmuşlardır. Ve protein türlerinin çeşitliliği çok büyüktür - bakteri Escherichia soy" gibi küçük bir organizmanın bir hücresinde ("Çalışmanın amacı prokaryotlardır" ek makalesine bakın), yaklaşık 3 bin farklı protein vardır.
Protein ilk olarak 1728'de İtalyan Jacopo Bartolomeo Beccari (1682-1766) tarafından buğday unundan (glüten formunda) izole edildi. Bu olay protein kimyasının doğuşu olarak kabul edilir. O zamandan beri, neredeyse üç yüzyıl boyunca, doğal kaynaklardan binlerce farklı protein elde edilmiş ve özellikleri araştırılmıştır.
BİYOLOJİK "BONCUKLAR"
Protein molekülü çok uzundur. Kimyacılar bu tür molekülleri polimerik olarak adlandırırlar (Yunanca "poli" - "çok" ve "meros" - "parça", "pay" dan). Gerçekten de uzun bir polimer molekülü birbirine bağlı birçok küçük molekülden oluşur. Bir kolyedeki ipe boncuklar bu şekilde dizilir. Polimerlerde, bir ipliğin rolü, boncuklar-moleküller arasındaki kimyasal bağlar tarafından oynanır.
Proteinlerin sırrı aynı boncukların özelliklerinde gizlidir. Çoğu polimer uzayda sabit bir şekil almaz, uzaysal bir yapıya sahip olamayan aynı boncuklar gibi olur: Boynunuza asarsanız, bir kutuya koyarsanız halka veya oval şeklini alırlar, belirsiz bir şekle sahip bir topun içine kıvrılacaklar. Şimdi de bazı boncukların birbiriyle "birbirine yapışabildiğini" hayal edelim. Örneğin, kırmızılar sarılara çekilir. O zaman tüm zincir, sarı ve kırmızı boncukların “birbirine yapışması” ile varlığından dolayı belirli bir form alacaktır.
Proteinlerde de benzer bir şey olur. Proteini oluşturan ayrı küçük moleküller, aralarında çekici kuvvetler hareket ettiğinden "birbirine yapışma" yeteneğine sahiptir. Sonuç olarak, herhangi bir protein zinciri, yalnızca kendisine özgü bir uzamsal yapıya sahiptir. Proteinlerin harika özelliklerini belirleyen odur. Böyle bir yapı olmadan canlı bir hücrede yaptıkları işlevleri yerine getiremezler.
Güçlü asitler veya alkaliler varlığında proteinlerin uzun süre kaynatılmasıyla, protein zincirleri kendilerini oluşturan moleküllere ayrılır,
amino asitler denir. Amino asitler, proteini oluşturan "boncuklardır" ve nispeten basittirler.
BİR AMİNO ASİT NASIL TASARLANIR
Her amino asit molekülünün dört ikameye bağlı bir karbon atomu vardır. Bunlardan biri bir hidrojen atomu, ikincisi bir karboksil grubu -COOH. Amino asitler adına "asit" kelimesinin mevcut olması nedeniyle hidrojen iyonu H +'yı kolayca "serbest bırakır". Üçüncü ikame amino grubudur - NH2 ve son olarak dördüncü ikame edici bir atom grubudur; Genel dava R'yi belirtmek Tüm amino asitlerin farklı R grupları vardır ve her biri kendi çok önemli rolünü oynar.
Bir amino asidi diğerinden ayıran "boncukların" özellikleri R gruplarında gizlidir (bunlara yan zincirler de denir). COOH grubuna gelince, organik kimyacılar onu büyük bir saygıyla ele alırlar: Moleküldeki diğer tüm karbon atomlarına, karboksil grubundan uzaklık derecelerine bağlı olarak atamalar verilir. Ona en yakın atoma a-atomu, ikincisine b-atomu, sonrakine y-atomu vb. denir. Amino asitlerdeki karboksil grubuna en yakın olan karbon atomu, yani a- atom ayrıca bir amino grubuyla da ilişkilidir, bu nedenle proteini oluşturan doğal amino asitlere a-amino asitler denir.
Doğada, NH^-grubunun karboksil grubundan daha uzaktaki karbon atomlarına bağlı olduğu amino asitler de vardır. Ancak doğa, proteinleri oluşturmak için a-amino asitleri seçti. Bunun başlıca nedeni, yalnızca uzun zincirlere bağlı a-amino asitlerin, büyük protein moleküllerinin yapısının yeterli mukavemetini ve stabilitesini sağlayabilmesidir.
R-grubunda farklılık gösteren a-amino asitlerin sayısı fazladır. Ancak diğerlerinden daha sık olarak, proteinlerde sadece 20 farklı amino asit bulunur. Protein molekülünün "dili"nin alfabesi olarak kabul edilebilirler. Kimyacılar bu ana amino asitleri standart, bazik veya normal olarak adlandırır. Geleneksel olarak, ana amino asitler dört sınıfa ayrılır.
Birincisi, polar olmayan yan zincirlere sahip amino asitleri içerir. İkincisinde - bir polar grup içeren amino asitler. Sonraki ikisi, pozitif (üçüncü bir sınıfta birleşirler) veya negatif (dördüncü) yüklenebilen yan zincirlere sahip amino asitlerdir. Örneğin, karboksil grubunun ayrışması bir anyon - COO- ve bir nitrojen atomunun protonasyonu - bir katyon, örneğin - NH3 + verir. Aspartik ve glutamik asitlerin yan zincirlerinin her biri, bir canlı hücrenin pH değerlerinde (pH = 7) bir hidrojen iyonu (H+) ile parçalanan ve negatif bir yük alan bir karboksil grubu COOH'ye sahiptir. Lizin, arginin ve histidin amino asitlerinin yan zincirleri, aksine bir hidrojen iyonu bağlayabilen nitrojen atomlarına sahip oldukları için pozitif yüklüdür.
Her bir a-amino asit (glisin hariç), dört ikame edicinin karşılıklı düzenlenmesine bağlı olarak iki biçimde var olabilir. Bir nesnenin aynadaki görüntüsü gibi veya sağ elin sol elden olması gibi birbirlerinden farklıdırlar. Bu tür bileşiklere koro denir (Yunanca "hir" - "el" den). Kiral moleküller 1848'de büyük Fransız bilim adamı Louis Pasteur tarafından keşfedildi. Organik moleküllerin iki tür optik izomeri, D-formu (Latince dexter - "sağ") ve Z-formu (Latince laevus - "sol") adlarını almıştır. Bu arada, diğer kiral moleküllerin adlarından biri - glikoz ve fruktoz - dekstroz ve levulozdur. Proteinlerin bileşimine yalnızca Z-amino asitlerin dahil edilmesi ve Dünya'daki tüm protein yaşamının "kalmış" olması dikkat çekicidir.
Normal işleyiş için vücudun eksiksiz bir 20 temel a-Z-amino asit setine ihtiyacı vardır. Ancak bazıları organizmanın kendi hücrelerinde sentezlenebilirken, diğerleri gıda ürünlerinden bitmiş formda gelmelidir. İlk durumda, amino asitlere gerekli olmayan ve ikincisinde - vazgeçilmez denir. İkincisinin seti, farklı organizmalar için farklıdır. Örneğin, beyaz bir sıçan için 10 amino asit ve laktik asit bakterileri için 16 amino asit vazgeçilmezdir.Bitkiler bağımsız olarak çok çeşitli amino asitleri sentezleyebilir, proteinlerde bulunmayanları yaratabilir.
Kolaylık sağlamak için, 20 ana amino asit, amino asidin Rusça veya İngilizce adının bir veya ilk üç harfi kullanılarak sembolize edilir, örneğin alanin - Ala veya A, glisin - Gly veya G.
PEPTİT NEDİR?
Uzun bir amino asit boncuk zincirine katılarak bir polimerik protein molekülü oluşturulur. A-karbon atomuna bağlı tüm amino asitlerde bulunan amino ve karboksil grupları nedeniyle bir dizi kimyasal bağ üzerine gerilirler.
Böyle bir reaksiyon sonucunda oluşan bileşiklere peptitler; (-CO- NH - içlerindeki grup bir peptit grubudur ve karbon ve azot atomları arasındaki bağ bir peptit bağıdır (amit bağı olarak da adlandırılır). Amino asitleri peptit bağları aracılığıyla bağlayarak, aşağıdakilerden oluşan peptitler elde edebilirsiniz. Bu tür bileşiklere polipeptitler denir.Protein molekülünün polipeptit yapısı 1902 yılında Alman kimyager Emil Hermann Fischer tarafından kanıtlanmıştır.
Amino asit zincirinin uçlarında serbest amino ve karboksil grupları bulunur; zincirin bu uçlarına N- ve C-terminalleri denir. Polipeptit zincirindeki amino asit kalıntıları genellikle N-ucundan itibaren numaralandırılır.
Bir protein molekülündeki amino asit kalıntılarının toplam sayısı çok geniş bir aralıkta değişir. Böylece insan insülini 51 amino asit kalıntısından, emziren anne sütü lizozim ise 130 amino asit kalıntısından oluşur. İnsan hemoglobininde her biri yaklaşık 140 amino asitten oluşan 4 amino asit zinciri vardır. Tek bir zincirde 3 bine yakın amino asit kalıntısına sahip proteinler var.
Proteinlerin moleküler ağırlıkları, 100 amino asit kalıntısından oluşan küçük proteinler için yaklaşık 11.000'den çok uzun polipeptit zincirlerine sahip proteinler veya birkaç polipeptit zincirinden oluşan proteinler için 1 milyon veya daha fazlasına kadar değişir.
Soru ortaya çıkıyor: Sadece 20 molekülden farklı işlevlere ve özelliklere sahip çok çeşitli proteinlerin tamamı nasıl oluşturulabilir? Ve doğanın bu sırrının anahtarı basittir - her proteinin kendi benzersiz amino asit bileşimi ve proteinin birincil yapısı olarak adlandırılan benzersiz bir amino asit kombinasyonu düzeni vardır.
Spiraller ve Katmanlar
50'lerin başında. 20. yüzyıl Kimyasal bağın doğası üzerine araştırmaları nedeniyle Nobel Ödülü'ne layık görülen Amerikalı kimyager Linus Karl Pauling (1901-1994) ve Robert Corey (1897-1971), proteinlerdeki amino asit zincirinin bazı bölümlerinin bükülerek büküldüğünü öne sürdüler. sarmal. Deneysel yöntemlerin geliştirilmesi sayesinde (proteinlerin yapısı X-ışınları kullanılarak incelenir), birkaç yıl sonra bu parlak varsayım doğrulandı.
Gerçekten de, polipeptit zincirleri çok sık olarak sağ-elli bir sarmal oluşturur. Bu, protein zincirlerinin ilk, en düşük uzamsal organizasyonudur.Bu, amino asit "boncuklarının" zayıf etkileşimlerinin rol oynamaya başladığı yerdir: C \u003d 0 grubu ve farklı peptit bağlarından N - H grubu oluşabilir kendi aralarında hidrojen bağı. Pauling ve Corey tarafından keşfedilen sarmalda, her i-inci amino asidin C = 0 grubu ile amino asidin N - H (i + 4) grubu, yani amino asitler arasında böyle bir bağın oluştuğu ortaya çıktı. dört "boncuk" aralıklı birbirine bağlı kalıntılardır. Bu hidrojen bağları, bir bütün olarak böyle bir sarmalı stabilize eder. A.-spiral adını aldı.
Daha sonra, amino asit zincirlerini katlamanın tek yolunun a sarmalı olmadığı ortaya çıktı. Spirallere ek olarak, katmanlar da oluştururlar. C = 0 ve N - H grupları arasındaki aynı hidrojen bağları sayesinde, bir polipeptit zincirinin birkaç farklı parçası aynı anda birbirine "yapışabilir". Sonuç olarak, bütün bir katman elde edilir - buna ^-katmanı denir.
Çoğu proteinde, a-helisleri ve p-tabakaları, belirli bir yapı olmaksızın her türlü kıvrım ve zincir parçası ile serpiştirilmiştir. Proteinin tek tek bölümlerinin uzaysal yapısıyla uğraşırken, protein molekülünün ikincil yapısından bahsederler.
UZAYDA PROTEİN
Bir protein molekülünün tam bir "portresini" elde etmek için birincil ve ikincil yapının bilgisi yeterli değildir. Bu bilgi, zincir bölümlerinin birbirine göre konumu bir yana, molekülün ne hacmi ne de şekli hakkında henüz bir fikir vermez. Ancak tüm spiraller ve katmanlar bir şekilde uzaya yerleştirilmiştir. Polipeptit zincirinin genel uzaysal yapısı, proteinin üçüncül yapısı olarak adlandırılır.
Protein moleküllerinin ilk uzaysal modelleri - miyoglobin ve hemoglobin - 50'lerin sonlarında inşa edildi. 20. yüzyıl İngiliz biyokimyacılar John Coudery Kendrew (1917 doğumlu) ve Max Ferdinand Perutz (1914 doğumlu). Bunu yaparken, x-ışınları deneylerinden elde edilen verileri kullandılar. Proteinlerin yapısı alanındaki araştırmalar için Kendrew ve Perutz, 1962'de Nobel Ödülü'ne layık görüldü. Ve yüzyılın sonunda, zaten birkaç bin proteinin üçüncül yapısı belirlendi.
Proteinin üçüncül yapısı oluştuğunda, amino asitlerin yan zincirleri olan R grupları nihayet aktivite gösterir. Onlar sayesinde, zincire uzayda belirli bir şekil vererek "boncuklar" - amino asitlerin çoğu kendi aralarında "birbirine yapışır".
Canlı bir organizmada proteinler her zaman su ortamında bulunur. Ve en fazla sayıda bazik amino asit - sekiz - polar olmayan R grupları içerir. Elbette protein, su ile temasını sınırlamak için polar olmayan yan zincirleri molekülünün içinde güvenilir bir şekilde saklama eğilimindedir. Bilim adamları buna hidrofobik etkileşimlerin ortaya çıkması diyorlar ("En küçük yaşam birimi" makalesine bakın).
Hidrofobik etkileşimler nedeniyle tüm polipeptit zinciri uzayda belirli bir şekil alır, yani üçüncül bir yapı oluşturur.
Diğer kuvvetler de protein molekülünde etkilidir. Ana amino asitlerin yan zincirlerinden bazıları negatif, bazıları ise pozitif yüklüdür. Negatif yükler pozitiflere çekildiğinden, karşılık gelen “boncuklar” “birbirine yapışır”. Elektrostatik etkileşimler veya başka bir deyişle tuz köprüleri, üçüncül yapıyı stabilize eden bir diğer önemli kuvvettir.
Yedi temel amino asidin polar yan zincirleri vardır. Aralarında proteinin uzamsal yapısının korunmasında da önemli bir rol oynayan hidrojen bağları oluşabilir.
Sisteinin iki amino asit kalıntısı arasında bazen oluşur kovalent bağlar(- S -S-), protein zincirinin farklı bölümlerinin konumunu birbirine göre çok sıkı bir şekilde sabitleyen. Bu tür bağlara disülfit köprüleri denir. Bunlar, proteinlerdeki en çok sayıda olmayan etkileşimlerdir (bazı durumlarda genellikle yoktur), ancak güç açısından eşitleri yoktur.
PROTEİNLERİN MEKANSAL ORGANİZASYONUNUN EN YÜKSEK DÜZEYİ
Bir protein molekülü bir değil birkaç polipeptit zincirinden oluşabilir. Bu tür zincirlerin her biri bağımsız bir mekansal yapıdır - bir alt birim. Örneğin, hemoglobin proteini, neredeyse düzenli bir tetrahedronun köşelerinde bulunan tek bir molekül oluşturan dört alt birimden oluşur. Alt birimler, üçüncül yapıyı stabilize eden aynı kuvvetler nedeniyle birbirine "yapışır". Bunlar hidrofobik etkileşimler, tuz köprüleri ve hidrojen bağlarıdır.
Bir protein birkaç alt birimden oluşuyorsa, dörtlü bir yapıya sahip olduğu söylenir. Böyle bir yapı en yüksek seviye Protein molekülünün organizasyonu. Farklı ilk üç Tüm proteinler kuaterner bir yapıya sahip değildir. Bugün bilinen proteinlerin yaklaşık yarısı buna sahip değildir.
PROTEİNLER NEDEN ISIDAN KORUR
Proteinin uzaysal yapısını destekleyen bağlar oldukça kolay bir şekilde yok edilir. Yumurtalar kaynatıldığında şeffaf yumurta beyazının elastik beyaz bir kütleye dönüştüğünü ve ekşidiğinde sütün kalınlaştığını çocukluktan biliyoruz. Bu, yumurta beyazındaki albümin proteinlerinin ve sütteki kazein (ogglat. caseus - “peynir”) uzamsal yapısının tahrip olması nedeniyle olur. Bu işleme denatürasyon denir. İlk durumda, ısınmadan ve ikincisinde asitlikte önemli bir artıştan (sütte yaşayan bakterilerin hayati aktivitesinin bir sonucu olarak) kaynaklanır. Denatürasyon sırasında, protein vücuttaki doğal işlevlerini yerine getirme yeteneğini kaybeder (dolayısıyla sürecin adı: Latince denaturare - “doğal özelliklerden yoksun bırakma”). Denatüre proteinler vücut tarafından daha kolay emilir, bu nedenle gıda ürünlerinin ısıl işleminin hedeflerinden biri proteinlerin denatürasyonudur.
NİÇİN MEKANSAL YAPIYA İHTİYAÇ VAR
Doğada neredeyse hiçbir şey tesadüfen olmaz. Eğer protein uzayda belirli bir şekil almışsa, bu belirli bir amaca ulaşmak için hizmet etmelidir. Gerçekten de, yalnızca "doğru" bir uzamsal yapıya sahip bir protein belirli özelliklere sahip olabilir, yani vücutta kendisine verilen işlevleri yerine getirebilir. Ve bunu aynı R-grupları amino asitlerin yardımıyla yapar. Yan zincirlerin sadece uzayda protein molekülünün "doğru" şeklini korumakla kalmadığı ortaya çıktı. R grupları diğer organik ve inorganik molekülleri bağlayabilir, kimyasal reaksiyonlarda yer alabilir, örneğin bir katalizör olarak hareket edebilir.
Çoğu zaman, polipeptit zincirinin uzamsal organizasyonu, "belirli bir işlevi yerine getirmek için gerekli yan zincirler kümesini uzayda belirli noktalarda yoğunlaştırmak için" ihtiyaç duyulur. proteinler.
ENZİMLERİN SIRRI NEDİR
Hücrede meydana gelen tüm kimyasal reaksiyonlar, özel bir protein sınıfı - enzimler nedeniyle meydana gelir. Bunlar katalitik proteinlerdir. Diğer katalizörlerden çok daha verimli çalışmalarını sağlayan ve reaksiyonları milyarlarca kez hızlandıran kendi sırları vardır.
Birkaç arkadaşın hiçbir şekilde buluşamayacağını varsayalım. Ancak içlerinden biri arkadaşlarını bir doğum günü partisine davet eder etmez sonuç çok uzun sürmedi: herkes belirlenen saatte aynı yerdeydi.
Toplantının gerçekleşmesi için arkadaşları iletişime geçmeye zorlamak gerekiyordu. Enzim de aynı şeyi yapar. Molekülünde sözde bağlanma merkezleri vardır. Belirli bir kimyasal bileşik türü için çekici olan “rahat sandalyeler” içerirler (ve sadece onlar için!) - Reaksiyona giren maddelerin moleküllerinin bazı bölümlerini birbirine bağlayan R grupları. Örneğin moleküllerden biri polar olmayan bir gruba sahipse, bağlanma merkezinde hidrofobik yan zincirler bulunur. Molekülde negatif yük varsa, pozitif yüklü R grubu enzim molekülünde onu bekleyecektir.
Sonuç olarak, her iki reaktif molekül de enzime bağlanır ve birbirine çok yakındır. Ayrıca, katılmaları gereken gruplar Kimyasal reaksiyon, reaksiyon için gerekli şekilde uzayda yönlendirilir. Artık enzimin katalizör görevi yapan yan zincirleri devralınmıştır. Enzimde her şey, R-grupları-katalizörleri de aktif merkez olarak adlandırılan olayların bulunduğu yere yakın olacak şekilde “düşünülür”. Ve reaksiyonun tamamlanmasından sonra, enzim ürün moleküllerini "saldırır" ("Enzimler tüm işlemlerin ustasıdır" makalesine bakın).
BAĞIŞIKLIK NEREDEN GELİR
Proteinler vücutta birçok işlevi yerine getirir; örneğin, hücreleri istenmeyen izinsiz girişlerden korurlar, onları hasardan korurlar. Özel proteinler - antikorlar, hücrelere giren bakterileri, virüsleri, yabancı polimer moleküllerini tanıma ve onları nötralize etme yeteneğine sahiptir.
Daha yüksek omurgalılarda, bağışıklık sistemi vücudu yabancı parçacıklardan korur. Bu tür "saldırganlar" - antijenler tarafından işgal edilen vücut, antikor üretmeye başlayacak şekilde tasarlanmıştır. Antikor molekülü antijene sıkıca bağlıdır: enzimler gibi antikorların da bağlanma merkezleri vardır. Amino asitlerin yan zincirleri, bu tuzağa düşen antijen artık antikorun “demir pençelerinden” kaçamayacak şekilde merkezlerde yer alır. Antikora bağlandıktan sonra düşman vücuttan atılır.
Vücuda, bulaşıcı bir hastalığa neden olan bakteri veya virüslerin parçası olan belirli polimer moleküllerinden az miktarda girebilirsiniz.
Karşılık gelen antikorlar vücutta hemen görünecektir. Artık kana veya lenfe giren “gerçek” patojenik mikrop, bu antikorlar tarafından hemen saldırıya uğrayacak ve hastalık yenilecektir. Bir enfeksiyonla bu şekilde savaşmanın yolu, pek çok kişi tarafından sevilmeyen bir aşıdan başka bir şey değildir. Bu sayede vücut bulaşıcı hastalıklara karşı bağışıklık kazanır.
DEMİR NEDEN HEMOGLOBİNDE BULUNUR
Doğada, amino asitlere ek olarak lipidler, şekerler, metal iyonları gibi diğer kimyasal bileşenleri içeren proteinler vardır. Genellikle bu bileşenler, proteinin biyolojik işlevinin performansında önemli bir rol oynar. Böylece, moleküllerin ve iyonların bir organdan diğerine transferi, kan plazmasının taşıma proteinleri tarafından gerçekleştirilir. Hemoglobin proteini (Yunanca "heme" - "kan" ve Latince globus - "top", "top") kan hücrelerinde bulunur - eritrositler (Yunanca "eritros" - "kırmızı" ve "kitos" - " hücre"), akciğerlerden dokulara oksijen verir. Hemoglobin molekülünde, hem adı verilen karmaşık bir organik molekül ile demir iyonu Fe 24'ün bir kompleksi vardır. Hemoglobin, dört protein alt biriminden oluşur ve her biri bir hem içerir.
Demir iyonu, akciğerlerdeki oksijenin bağlanmasına doğrudan katılır. Alt birimlerden en az birinde oksijen eklenir eklenmez, iyonun kendisi protein molekülündeki yerini hemen hafifçe değiştirir. Demirin hareketi, üçüncül yapısını hafifçe değiştiren bu alt birimin tüm amino asit zincirinin hareketini "tahrik eder".
Henüz oksijen eklememiş başka bir alt birim, komşusuna ne olduğunu “hissediyor”. Yapısı da değişmeye başlıyor. Sonuç olarak, ikinci alt birim oksijeni birinciden daha kolay bağlar. Üçüncü ve dördüncü alt birimlere oksijen eklenmesi daha da az zorlukla gerçekleşir. Gördüğünüz gibi, alt birimler işlerinde birbirlerine yardım ediyor. Bunun için hemoglobinin kuaterner bir yapıya ihtiyacı vardır. Karbon monoksit CO (halk dilinde karbon monoksit), demire oksijenden yüzlerce kat daha güçlü bağlanır. Karbon monoksit insanlar için ölümcüldür, çünkü hemoglobini oksijen bağlama yeteneğinden yoksun bırakır.
VE DAHA FAZLA PROTEİN...
Besin görevi görürler. Birçok bitkinin tohumları (buğday, mısır, pirinç vb.) gıda proteinleri. Ana bileşen olan albümini de içerirler. yumurta akı ve sütteki ana protein olan kazein. Proteinli besinler insan vücudunda sindirildiğinde peptit bağlarının hidrolizi meydana gelir. Proteinler, vücudun daha sonra yeni peptitler “oluşturduğu” veya bunları enerji için kullandığı bireysel amino asitlere “parçalanır”. Dolayısıyla adı:
Yunanca "peptos" kelimesi "sindirilmiş" anlamına gelir. İlginç bir şekilde, peptit bağının hidrolizi de proteinler - enzimler tarafından kontrol edilir.
Hücresel ve fizyolojik aktivitenin düzenlenmesine katılın. Bu proteinler, glikoz metabolizmasını düzenleyen insülin ve büyüme hormonu gibi birçok hormonu (Yunanca "gormao" - "uyarıyorum") içerir.
Vücuda şekil değiştirme ve hareket etme yeteneği verirler. Kasların yapıldığı aktin ve miyozin proteinleri bundan sorumludur.
Destekleyici ve koruyucu işlevler yerine getirirler, biyolojik yapıları sabitlerler ve onlara güç verirler. Cilt neredeyse saf kolajen proteinidir, saç, tırnaklar ve tüyler ise sert, çözünmeyen protein keratinden oluşur.
GENLERDE NE YAZILIR
Proteinlerdeki amino asitlerin dizisi, DNA molekülleri kullanılarak depolanan ve kalıtılan genler tarafından kodlanır ("Kalıtsal bilginin koruyucusu. DNA" ve "Gen ifadesi" makalelerine bakın). Bir proteinin uzaysal yapısı, kesin olarak amino asitlerin düzenlenme sırasına göre belirlenir. Proteinlerin sadece birincil değil, aynı zamanda ikincil, üçüncül ve dördüncül yapılarının da kalıtsal bilgilerin içeriğini oluşturduğu ortaya çıktı. Sonuç olarak, proteinlerin gerçekleştirdiği işlevler genetik olarak programlanmıştır. Bu işlevlerin büyük bir listesi, proteinlerin haklı olarak yaşamın ana molekülleri olarak adlandırılmasına izin verir. Dolayısıyla proteinler hakkında bilgi, doğada nesilden nesile aktarılan paha biçilmez bir hazinedir.
Bu organik bileşiklere olan insan ilgisi sadece her yıl artmaktadır. Bugün bilim adamları, birçok protein molekülünün yapısını zaten deşifre ettiler. Çeşitli proteinlerin işlevlerini öğrenirler, işlevler ve yapı arasındaki ilişkiyi belirlemeye çalışırlar. Farklı canlı organizmalarda benzer işlevleri yerine getiren proteinlerde benzerlikler ve farklılıklar oluşturmak, evrimin sırlarına daha derinden inmenizi sağlar.
AMİNO ASİTLER - YAŞ GÖSTERGELERİ
D - ve L - amino asit formları çok yavaş birbirine dönüşme yeteneğine sahiptir. Belirli (çok uzun) bir süre boyunca, saf bir D- veya I-formu, her iki formun eşit miktarlarda karışımı haline gelebilir. Böyle bir karışıma raiemagom denir ve sürecin kendisine raie-mizaiiya denir. Rasemizasyon hızı, sıcaklığa ve amino asit tipine bağlıdır. Bu özellik, organizmaların ve gerekirse canlıların fosil kalıntılarının yaşını belirlemek için kullanılabilir. Örneğin, dentin proteininde (dentin, dişlerin kemik dokusudur), 1-ac-partik asit yılda %0.1 oranında spontane olarak bulunur. Çocuklarda diş oluşumu döneminde dentin sadece 1-aspartik asit içerir. Dentin dişten izole edilir ve içindeki 0 formunun içeriği belirlenir. Test sonuçları oldukça doğru. Yani yaşı belgelenen 97 yaşındaki bir kadın için test, 99 yaşını gösterdi. Tarih öncesi hayvanların (filler, yunuslar, ayılar) fosil kalıntıları üzerinde yapılan çalışmaların verileri, radyonüklid yöntemiyle elde edilen tarihleme sonuçlarıyla iyi bir uyum içindedir.
SENGER NOBEL ÖDÜLLERİNİ NEDEN ALDI
Proteinlerin amino asitlere hidrolizi sırasında (su ile peptit bağının yok edilmesi), bağlantılarının sırası hakkında bilgi kaybolur. Bu nedenle, uzun bir süre bir proteinin birincil yapısını belirlemenin tamamen umutsuz bir iş olduğuna inanılıyordu. Ama 50'lerde. 20. yüzyıl İngiliz biyokimyacı Frederick Sanger (1918 doğumlu), insülin hormonunun polipeptit zincirlerindeki amino asit dizisini deşifre edebildi. Tamamlanması birkaç yıl süren bu çalışma için 1958'de Sanger Nobel Kimya Ödülü'ne layık görüldü (yirmi yıl sonra W. Gilbert ile birlikte DNA'nın birincil yapısının kurulmasına katkılarından dolayı ikincilik ödülü aldı) .
İlk olarak Sanger tarafından formüle edilen amino asit dizisini belirleme ilkeleri, her türlü varyasyon ve iyileştirme ile bugün hala kullanılmaktadır. Bir proteinin birincil yapısını oluşturma prosedürü karmaşık ve çok aşamalıdır: İçinde yaklaşık bir düzine farklı aşama vardır. İlk olarak, protein tek tek amino asitlere ayrılır ve bunların belirli bir maddedeki türü ve miktarı belirlenir. Bir sonraki aşamada, uzun bir protein molekülü artık tamamen bölünmez, parçalara ayrılır. Daha sonra bu fragmanlarda amino asitlerin birbiri ardına ayrılarak bağlanma sırası belirlenir. Proteinin parçalara bölünmesi, farklı parçalarda örtüşen bölümler olacak şekilde çeşitli şekillerde gerçekleştirilir. Tüm fragmanlardaki amino asitlerin sırasını öğrendikten sonra, amino asitlerin proteinde nasıl yer aldığı hakkında eksiksiz bilgi alırlar. XX yüzyılın sonunda. bir protein molekülündeki amino asitlerin sırasını otomatik olarak belirleyen özel cihazlar - sıralayıcılar (İngiliz dizisinden - “sıradan”).
SÜT VE SÜT ÜRÜNLERİ
Süt, sudaki kolloidal bir yağ çözeltisidir. Mikroskop altında heterojen olduğu açıkça görülür: yağ küreleri renksiz bir çözelti (serum) içinde yüzer.
İnek sütü genellikle %3 ila %6 yağ içerir (çoğunlukla gliserol ve doymuş yağ esterleri) karboksilik asitler- palmitik, stearik), proteinlerin yaklaşık %3'ü ve ayrıca karbonhidratlar, organik asitler, vitaminler ve mineraller.
Sütteki kazein proteini bağlı bir biçimde bulunur - amino asit serinine kovalent olarak bağlı fosfat grupları kalsiyum iyonları ile tuzlar oluşturur. Süt asitleştirildiğinde, bu tuzlar yok edilir ve kazein, beyaz bir lor kütlesi şeklinde salınır. İnsan midesinde, özel enzimlerin etkisi altında "kazein kıvrılması" adı verilen bir süreç meydana gelir. Kıvrılmış kazein çökelir ve vücuttan daha yavaş atılır ve bu nedenle daha tam olarak emilir. Kazein son derece besleyicidir:
Bir kişinin kendi proteinlerini oluşturması için ihtiyaç duyduğu neredeyse tüm amino asitleri içerir. AT saf formu suda çözünmeyen tatsız beyaz bir tozdur. Buna ek olarak süt, laktalbümin gibi diğer proteinleri de içerir. Kaynatıldığında, bu protein çözünmeyen bir forma dönüşür ve kaynamış süt köpüğünün yüzeyinde karakteristik beyaz bir film oluşturur.
Sütün bir parçası olan şeker laktoz C^HdgO sakaroza izomerize edilir. İnsan vücudunda, laktaz enziminin etkisi altında, bu şeker, kolayca emilen monosakkaritler olan glikoz ve galaktoza parçalanır. Bu nedenle, örneğin, bebekler karbonhidrat depolarını yeniler. Birçok insanda (esas olarak Moğol ırkının temsilcileri), yetişkinlikte vücudun laktozu parçalama yeteneğini kaybetmesi ilginçtir.
Sindirim sisteminden geçen laktoz emilmez, ancak genel rahatsızlığa yol açan çeşitli patojenlerin gelişimi için bir üreme alanı haline gelir. Bu nedenle Uzak Doğu halkları (Japon, Çin) pratikte süt ürünlerini yiyeceklerde kullanmazlar.
Endüstriyel koşullar altında süt, amacı mikroorganizmaların gelişimini bastırmak ve raf ömrünü uzatmak olan ısıl işleme tabi tutulur. Bunu yapmak için süt pastörize edilir - 65 ° C'de 30 dakika tutulur ve kısa süreli ısıl işlem de kullanılır - 10-20 s ila 71 ° C'ye ısıtılır. Pastörizasyonla karşılaştırıldığında, ısıl işlem besinleri, özellikle de vitaminleri daha iyi korur. Sütün krema ve peynir altı suyuna ayrılmaması için homojenize edilir - küçük deliklerden basınç altında geçirilir. Yağ kürecikleri ezilir, boyutları küçülür ve süt daha viskoz hale gelir.
Sütün önemli bir kısmı işlenmeye gider - tereyağı, peynir ve süt ürünleri (kefir, fermente pişmiş süt, kesilmiş süt, ekşi krema) üretimi için.
Kefir elde etmek için süt fermente edilir - bir laktik asit bakterisi tohumu eklenerek 20-25 ° C'de 8-10 saat tutulur. Eylemleri altında laktoz, laktik aside parçalanır:
Сн„о„ + n,® = laktoz == 4CH3CH(OH)COOH. laktik (2-hidroksipropanoik) asit
Kefirin kendine özgü tadını belirleyen laktik asittir. Çözeltide biriktikçe, serbest bir biçimde salınan kazeinin pıhtılaşması (pıhtılaşması) meydana gelir. Bu nedenle kefir, sütten daha kalın bir kıvama sahiptir. Laktozun laktik asit fermantasyonuna alkolik fermantasyon eşlik eder, çünkü fermente süt ürünleri, özellikle kefirde az miktarda alkol vardır (% 0.03'e kadar). Fermente süt ürünleri ayrıca patojenik bakterilerin gelişimini engelleyen ve böylece sindirimi iyileştiren mikroorganizmalar içerir.
Süzme peynir, sütün laktik asit bakterileri ile fermente edilmesiyle de elde edilir. Onun ana ayrılmaz parça protein kazeindir.
Hazırlamak Tereyağı, sütü oluşturan yağ damlacıklarını peynir altı suyundan ayırmak gerekir. Bunu yapmak için krema çalkalanır - sütün çökmesi sırasında oluşan üst, daha yağlı tabaka.
Kazein peynirlerde de bulunur. Süte bakteri başlatıcı ve özel enzimler eklendikten sonra karışımın belirli bir sıcaklığa ısıtılmasıyla yapılırlar. Enzimler tekrar salınan pıhtıya verilir ve ısıtılır. Bu durumda kazeinin yapısında ve bileşiminde kısmi bir değişiklik olur. Daha sonra karışım kalıplara yerleştirilir ve uzun bir süre - altı aya kadar - düşük bir sıcaklıkta (15 ° C'den yüksek olmayan) tutulur. Olgunlaşma sırasında kazein, enzimlerin etkisi altında polipeptitlere ve serbest amino asitlere ayrışır. Amino asitlerin bir kısmı atmosferik oksijen tarafından oksitlenir ve peynire karakteristik bir tat veren amonyak, aldehitler ve ayrıca keto asitler oluşur.
Ekşi süt, protein denatürasyonunun yaygın bir örneğidir.
BAKIR KAN
Peru akımının soğuk sularında Pasifik Okyanusu Kalamar Dosidicus gigas'ın yaşadığı. Puro şeklindeki gövdesi, dokunaçlarla birlikte 3.5 m uzunluğa ulaşır ve bir devin kütlesi 150 kg'ı geçebilir. Güçlü fareler, kalamarın 40 km / s hıza kadar hareket edebilmesi sayesinde, bir yangın hortumundan attığı kuvvetle bir su jeti atar. Çok güçlü ve keskin bir gaga ile çelik bir kabloyu kırabilir. Görgü tanıklarına göre, kalamar tam anlamıyla 20 kilogramlık bir balığı parçalara ayırıyor. Bu vahşi yırtıcı insanlar için çok tehlikelidir. Frank Lane'in The Kingdom of the Octopus adlı kitabında "birçok kalamarın yaşadığı yerde denize düşen bir adam yarım dakika yaşayamaz" der.
Enerji ile “şarj etmek” için, bu okyanus sakini çok fazla oksijene ihtiyaç duyar - saatte en az 50 litre. Deniz suyundan gelen oksijen, bakır - hemianin (Yunanca "hema" - "kan" ve "kyanos" - "masmavi", "mavi") içeren özel bir protein yardımıyla kalamarın gövdesi boyunca taşınır.
Omurgalıların kanında oksijenin, hemoglobin proteininin bir parçası olan özel bir kompleks molekül olan hem bileşimindeki demir atomları tarafından “taşındığını” belirtmekte fayda var. Kelimenin tam anlamıyla kırmızı kan hücreleri - eritrositler ile doldurulurlar. Hemoglobin molekülü, her biri bir oksijen molekülünü bağlayabilen dört hem parçası içerir. Hemoglobinden farklı olarak, bakır atomları, herhangi bir hücreye dahil olmayan, ancak kanda serbestçe "yüzen" protein molekülleriyle doğrudan ilişkilidir. Ama bir molekül hemoiiani
200 bakır atomuna kadar bağlayabilir. Ve hemoiiani-na'nın bir özelliği daha var - molekülleri proteinler için bile çok büyük. Yumurta, süt, fareyi oluşturan “sıradan” proteinler, moleküler kütle 6 bin ila 1 milyon arasında değişir ve hemianinin moleküler ağırlığı 10 milyona ulaşabilir! Bu en büyük proteinlerden biridir; sadece virüslerin protein kompleksleri boyut ve kütle olarak daha büyüktür.
Hemoiyanin çok eski bir sincaptır. Hemoglobinden daha basittir ve o kadar etkili değildir. Bununla birlikte, deniz suyundaki düşük oksijen içeriği ile hemianin, soğukkanlı hayvanların dokularına oksijeni oldukça başarılı bir şekilde sağlar. Yani ıstakozun solungaçlarındaki oksijen basıncı sadece 7 mm Hg'dir. Sanat. (930 Pa) ve dokularda - 3 mm Hg. Sanat.; Ayrıca ıstakozun kanındaki bu gazın konsantrasyonu deniz suyundakinden 20 kat daha fazladır.
Oksijen, kalamarların yanı sıra on ayaklı kabuklularda da (ıstakoz, yengeç, karides) “mavi kan” tarafından taşınır. Hemoiian herkeste bulunur kafadanbacaklılar(ahtapot, kalamar, mürekkep balığı), çeşitli salyangoz, örümcek vb. Deniz tarağı, istiridye ve diğer çift kabuklular mevcut değildir.
Kandaki hemianin miktarı çok farklı olabilir. Böylece, çevik ahtapot ve at nalı yengecinde (eklem bacaklı tipi bir deniz hayvanı), bu olağandışı proteinin konsantrasyonu, 100 ml kan başına 10 g'a ulaşır - insan kanındaki hemen hemen aynı miktarda hemoglobin. Aynı zamanda, yerleşik, yenilebilir yumuşakça abalone Hatiotis tuberculata, 100 ml kanda sadece 0.03 g hemianine sahiptir. Bu anlaşılabilir bir durumdur: hayvan ne kadar aktifse,
Enerji maliyetlerini yenilemek için ne kadar fazla oksijene ihtiyaç duyarsa, kandaki oksijen taşıyan protein konsantrasyonu o kadar yüksek olur.
Hemoianin 60'larda keşfedildi. XIX yüzyıl, biyologlar solungaçlardan geçerken kafadanbacaklıların kanının maviye döndüğünü fark ettiğinde. Ve 1878'de Belçikalı fizyolog Leon Frederick, mavi rengin oksijenin hemianin adını verdiği bakır içeren bir proteinle reaksiyona girmesinden kaynaklandığını kanıtladı. İkincisi oksijeni kaybettiğinde, hemoglobinin aksine renksiz hale gelir. Frederick'in yeni protein çalışmasıyla ilgili tüm çalışmaları bir gün içinde tamamlaması dikkat çekicidir.
Bakırın hemianinden tamamen çıkarılması zor değildir. Alya, oksijenin yokluğunda proteini tek değerli bakır iyonlarına güçlü bir şekilde bağlanan bir reaktif ile tedavi etmek yeterlidir. Aynı şekilde hemianindeki bakır içeriğini de belirleyebilirsiniz. Bu metalden yoksun bırakıldığında oksijen taşıma yeteneğini kaybeder. Ancak Cu-1 iyonları daha sonra protein çözeltisine dahil edilirse, hemianin fizyolojik aktivitesini eski haline getirir.
Böylece oksijen yokluğunda hemianinin bakırının +1 oksidasyon durumunda olduğu kanıtlandı. Bu gazın fazlalığı ile metalin kısmi oksidasyonu meydana gelir. Bu durumda, hemianine bağlı oksijen molekülü başına her zaman iki bakır atomu vardır. Böylece oksijen, bakır atomlarının tam olarak yarısını oksitler. Bu, tüm demir atomlarının eşit olduğu ve hem serbest halde hem de oksijen ile kombinasyon halinde +2 yüke sahip olduğu hayvan dünyasında çok daha yaygın olan hemianin ve hemoglobin arasındaki başka bir farktır.