Sätt att koppla aminosyror i en proteinmolekyl
Den huvudsakliga strukturella enheten för proteinet är a-aminosyror.
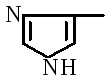
För första gången, redan 1888, fastställde A.Ya Danilevsky att aminosyror i en proteinmolekyl är sammankopplade med -COOH- och -NH 2 -grupper och bildar bindningar, senare kallade peptidbindningar. En peptidbindning bildas genom interaktionen av karboxylgruppen i den första aminosyran med aminogruppen vid α-kolet i den andra aminosyran. I det här fallet delas en vattenmolekyl av: till exempel bildas en alanyl-alanin-dipeptid av två alaninmolekyler:
En förening av två aminosyror kallas en dipeptid, en av tre kallas en tripeptid och så vidare. Förbindelse – CO- NH- kallas en peptidbindning.
Om antalet aminosyrarester över 10, sedan ringde polypeptid, över 50–proteiner. Skilja på N-slutet, där det finns en fri -NH2-grupp och C-terminal peptid, där den fria -COOH-gruppen i aminosyran. Förutom -COOH- och -NH2-grupper som är involverade i bildandet av en peptidbindning, innehåller aminosyror andra funktionella grupper som finns i sidogrenarna av proteinmolekylen:
|
asparaginsyra och glutaminsyror |
|
|
lysin, oxylysin, |
|
|
|
guanidylgrupp av arginin |
|
|
imidazolgrupp av histidin |
|
serin och treonin |
|
|
|
fenolgruppen av tyrosin |
|
sulfhydrylgrupp i cystein |
|
|
tioetergrupp av metionin |
|
|
bensenring av fenylalanin |
|
|
alifatiska kedjor av andra aminosyror, etc. |
En grupp atomer i aminosyramolekyler som inte deltar i bildandet av en peptidbindning kallas aminosyraradikaler. Det finns aminosyror med radikaljoner. Denna grupp inkluderar 7 aminosyror med radikaler med negativa eller positiva laddningar, inkl. asparaginsyra och glutaminsyror med en "-"-laddning, tyrosin och cystein kan också bära en "-"-laddning; lysin, arginin och histidin bär en "+"-laddning.
Polära radikaler har serier och treonin (-OH). Detta inkluderar även asparagin, glutamin. Den tredje gruppen av aminosyror har opolära alifatiska eller aromatiska radikaler (alanin, valin, leucin, isoleucin, metionin, fenylalanin, tryptofan, prolin, hydroxiprolin). Sålunda, vid uppbyggnaden av strukturen hos en proteinmolekyl, förutom bildandet av en peptidbindning, är egenskaperna hos aminosyraradikaler viktiga.
Peptider - ha Mm upp till 5000 dalton (50 aminosyrarester), passera genom ett semipermeabelt membran. I naturen är mer än 200 peptider kända, inklusive i kroppen hos djur och människor skiljer de åt:
1. Peptider-hormoner: vasopressin, oxytocin, kortikotropin, glukagon, kalcitonin, melanostimulerande hormon.
2. Peptider involverade i matsmältningen - gastrin, sekretin - totalt 12 peptider.
Z. Angiotensin (vasokonstriktor), bradykinin.
4. Neuropeptider.
b. Peptider med låg molekylvikt (Mm 4 kDa) som gör djur resistenta mot olika infektioner och har ett brett spektrum av antimikrobiell aktivitet.
Det finns peptider som erhålls genom syntes. Till exempel är ett syntetiskt peptidvaccin mot mul- och klövsjuka härlett från 16 aminosyrarester. Den icke-proteiniska delen av redoxenzymet är en tripeptid: det är glutation (γ-glutamyl-cysteinyl-glycin):
Karnosin: β-alanyl-histidin och anserine-metyl-karnosin är dipeptider: de förstärker muskelsammandragningar, har antioxidant och membranstabiliserande egenskaper. Peptider från glycin och prolin påverkar blodets koagulering, skyddar magslemhinnan och påverkar hjärnan. Endotelinpeptider reglerar vaskulär tonus.
dipeptid aspartam(asparagin + fenylalanin) erhålls med metoden genteknik. Det är 300 gånger sötare än socker, det läggs till drycker istället för socker (Coca-Cola).
Det finns 4 strukturnivåer för proteinmolekylen.
Primär struktur av ett protein - detta är sekvensen (alterneringen) av aminosyrarester i peptidkedjan. Peptidbindningar, delvis disulfidbindningar, deltar i bildandet av denna struktur. Den primära strukturen är kodad i generna, den bestämmer de återstående nivåerna av proteinorganisation. Den primära strukturen av insulinproteinet bestämdes först av Sanger (1953). Den primära strukturen hos ett stort antal proteiner har nu studerats. Till exempel består insulinmolekylen av två delar: A-21, B-30 aminosyrarester.
Dess struktur kan representeras enligt följande:
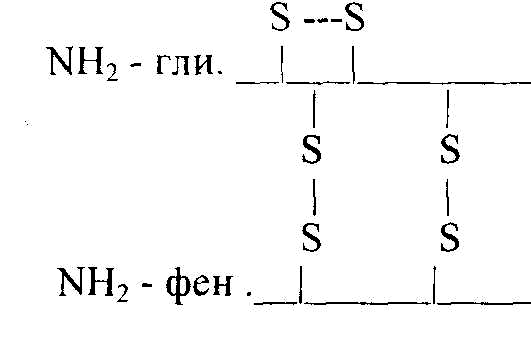 asp. COOH A-kedja (21 aminosyrarester)
asp. COOH A-kedja (21 aminosyrarester)
COOH i kedja (30 aminosyrarester)
Disulfidbindningar bildas mellan kedjorna A och B och inom A-kedjan. Den primära strukturen för ett RNas med 124 aminosyrarester visas i fig. 2.2.
Studiet av hemoglobinets primära struktur gjorde det möjligt att fastställa att sickleformad anemi (Fig. 2.3.) - en blodsjukdom - orsakas av ersättning av endast en enda aminosyra i B-kedjan av 146 aminosyrarester.
Om valin istället för glutaminsyra är i 6-positionen från N-terminalen, utför sådant hemoglobin inte funktionen av syretransport:
4 5 6 7 - position för aminosyror
Tre - pro - glu - liz - norm
Tre - pro - skaft - liz - patologi
Sekundär struktur av ett protein är ett sätt att lägga en polypeptidkedja i en spiralformad konfiguration. Denna läggning sker enligt det program som fastställts i den primära strukturen.

Fig 2.2. Primär struktur av RNase. Fyra disulfidbindningar är markerade i färg.

Fig 2.3 Normala och skäreformade erytrocyter
Pauling och Corey fann att globulära proteiner bildar en α-helix på grund av vätebindningar mellan aminosyraradikaler. En vätebindning uppstår på grund av karbonylgruppen i en radikal och amingruppen i en annan radikal, mellan atomerna av syre och väte, kväve och väte:
Karbonylgruppen och NH-gruppen kan bilda en vätebindning med varandra. Peptidgruppens syre- och väteatomer upptar transpositionen, och fri rotation runt - CH är möjlig:
![]()
Som ett resultat avgör bildningen av vätebindningar den specifika formen på peptiden. Det finns tre typer av sekundär struktur av peptidkedjor: α-helix, β-struktur (vikt lager), slumpmässig spole.
En α-helix är en medurs spole (Fig. 2.4).
Varje varv innehåller 3,6 aminosyror 5,4 A (1,5 A per 1 aminosyra), vart femte varv (18 aminosyrarester) upprepas den strukturella konfigurationen, fibrillära proteiner har en α-spiralstruktur - keratiner av hår, ull, hud, där -S-S- bindningar ger hög styrka.
I det vikta lagret (β-strukturen) är peptidkedjorna arrangerade parallellt med varandra i ett lager och bildar en dragspels- eller bladform. Skiktet kan bildas av två eller flera peptider.
Domäner representerar en supra-sekundär struktur (Fig. 2.5).
En vätebindning kan bildas inte bara mellan karbonylgruppen (negativ syreladdning) och väteatomen i iminogruppen \u003d NH i en annan polypeptidkedja, utan också mellan två hydroxylgrupper
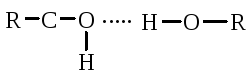
och hydroxylgruppen av serin och tyrosin.
sekundär struktur kollagen. Mängden kollagen i kroppen är 1/3 (senor, ligament, ledkapslar etc.) av den totala mängden proteiner.
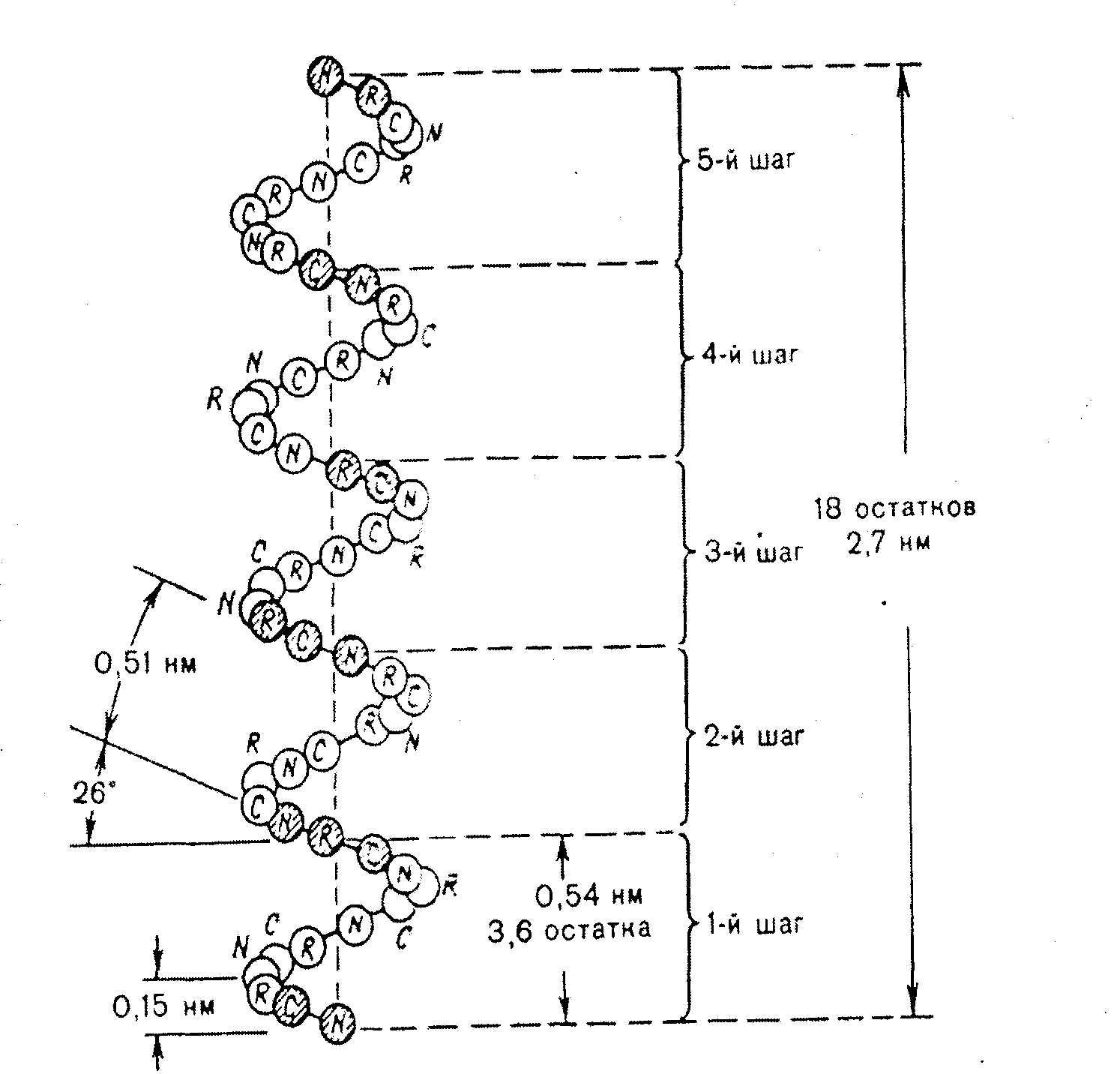
Ris. 2.4. Struktur och parametrar för α-helixen.
Till skillnad från keratins α-helix är kollagen svårt att sträcka. Kollagen innehåller mycket glycin - 1/3 av det totala antalet aminosyrarester, 1/4 eller fler är prolin och hydroxiprolin. Dessa aminosyror stör polypeptidkedjornas förmåga att bilda en α-helix. I kollagen vrids var tredje polypeptidkedjor och bildar en trippelhelix.
Tertiär struktur ekorre. Detta är den rumsliga orienteringen av polypeptidhelixen eller hur polypeptidkedjan läggs i en viss volym.
Det första proteinet, vars tertiära struktur klargjordes av engelsmannen J. Kendrew. Detta är kaskelotmyoglobin, molekylvikt 16700 Da, innehåller 153 aminosyrarester. Har en polypeptidkedja. Polypeptidkedjan presenteras i form av ett krökt rör, kompakt lagd runt hemen (icke-proteinkomponent som innehåller järn).
För närvarande, tack vare ökningen av effektiviteten av röntgendiffraktionsanalys, har den tertiära strukturen av många proteiner dechiffrerats.

Vikt lager Domäner
Ris. 2.5. Schema för det vikta lagret och domänerna.
Vissa typer av bindningar som stabiliserar den tertiära strukturen visas i figur 2.6. peptid
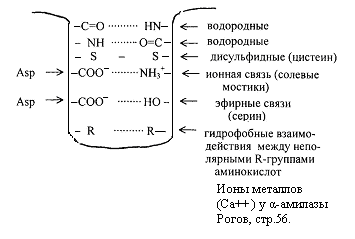
Fig.2.6. Obligationer som stabiliserar den sekundära och tertiära strukturen.
Den tertiära strukturen tillhandahålls av peptid- och disulfidbindningar, men huvudrollen spelas av icke-kovalenta bindningar - väte, intermolekylära Van der Waals-London-krafter, hydrofoba interaktioner, etc.
Den tertiära strukturen av ett protein uppstår automatiskt efter att dess syntes på ribosomer har slutförts. Det bestäms av den primära strukturen - sekvensen av aminosyrarester i polypeptidkedjan. Den tertiära strukturen är associerad med proteinmolekylens biologiska aktivitet (katalytisk, hormonell, antigen, etc.). Alla fysikaliska och kemiska påverkan som leder till att vätebindningar bryts, såväl som vissa andra bindningar, och därigenom förstör molekylens naturliga konformation, åtföljs av en partiell eller fullständig förlust av proteinet av dess biologiska egenskaper (Fig. 2.7. ).
Kvartär struktur ekorre. Detta är läggning i rymden av individuella polypeptidkedjor med samma (eller olika) primära, sekundära och tertiära struktur, och bildandet av en enda makromolekylär formation. Varje enskild polypeptidkedja (protomer) har oftast inte biologisk aktivitet. En biologisk molekyl förvärvar denna förmåga med ett visst sätt av rumslig association av dess ingående protomerer, vilket bildar en multimer.
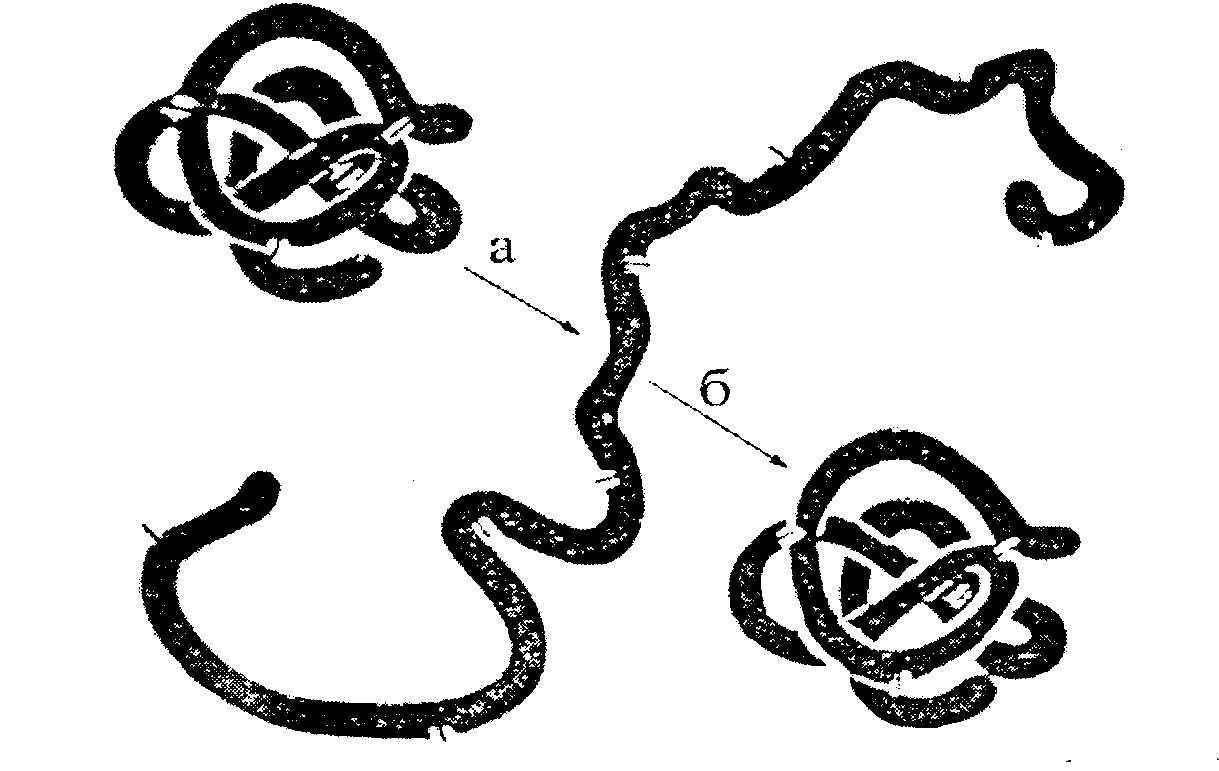
Fig.2.7. Denaturering och renaturering av ribonukleas (enligt Anfinsen).
a - utbyggnad (urea + merkaptoetanol);
b - återvikning
Till exempel består hemoglobinmolekylen av a- och β-subenheter, som var och en består av två polypeptidkedjor. Var och en av de fyra polypeptiderna omger en hemgrupp som innehåller en järnatom. Under vissa förhållanden i närvaro av salter, urea, förändringar i pH, molekyler; hemoglobin dissocierar reversibelt i 2 α- och 2 β-kedjor, vilket är associerat med brytningen av vätebindningar. Efter avlägsnande av salter, urea, när pH ändras, återställs den ursprungliga molekylen automatiskt (Fig. 2.8).
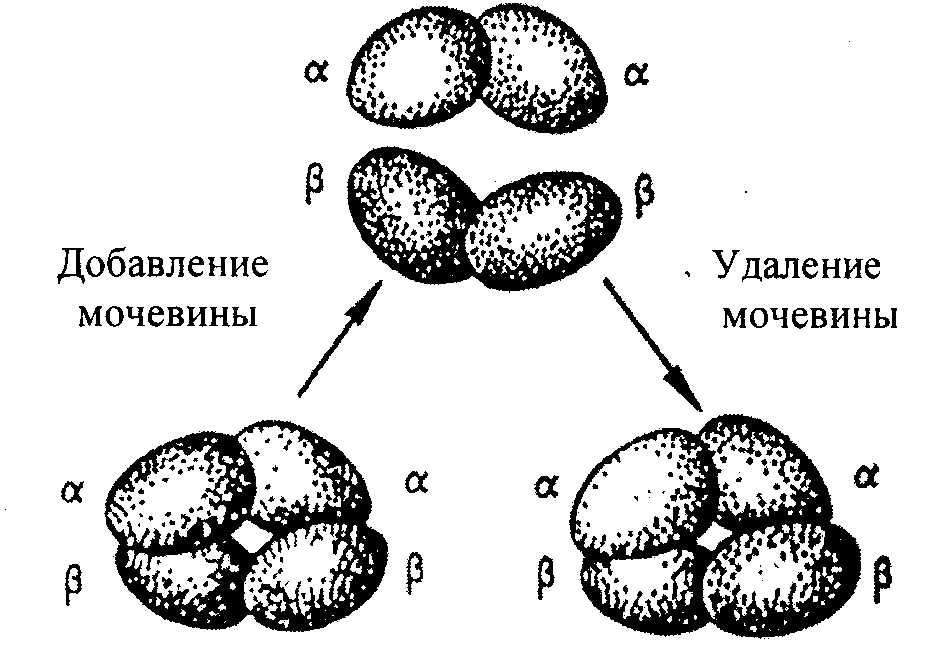
Fig.2.8. Reversibel dissociation av hemoglobinmolekylen.
Tobaksmosaikvirusproteinet har en jättemolekyl med en molekylvikt på cirka 40 x 10 b Da, viruset består av 1 RNA-molekyl och 2130 proteinsubenheter med en molekylvikt på 17500 Da vardera. Runt RNA:t finns proteinsubenheter som bildar en spiralformad struktur som har 130 varv. Efter tillsats av rengöringsmedel kan RNA:t avlägsnas; det som är mest överraskande - viruspartikeln kan samlas in igen automatiskt efter borttagning av rengöringsmedel. Samtidigt återställs också virusets biologiska egenskaper, smittsamhet, antigenaktivitet etc. (Fig. 2.9.).
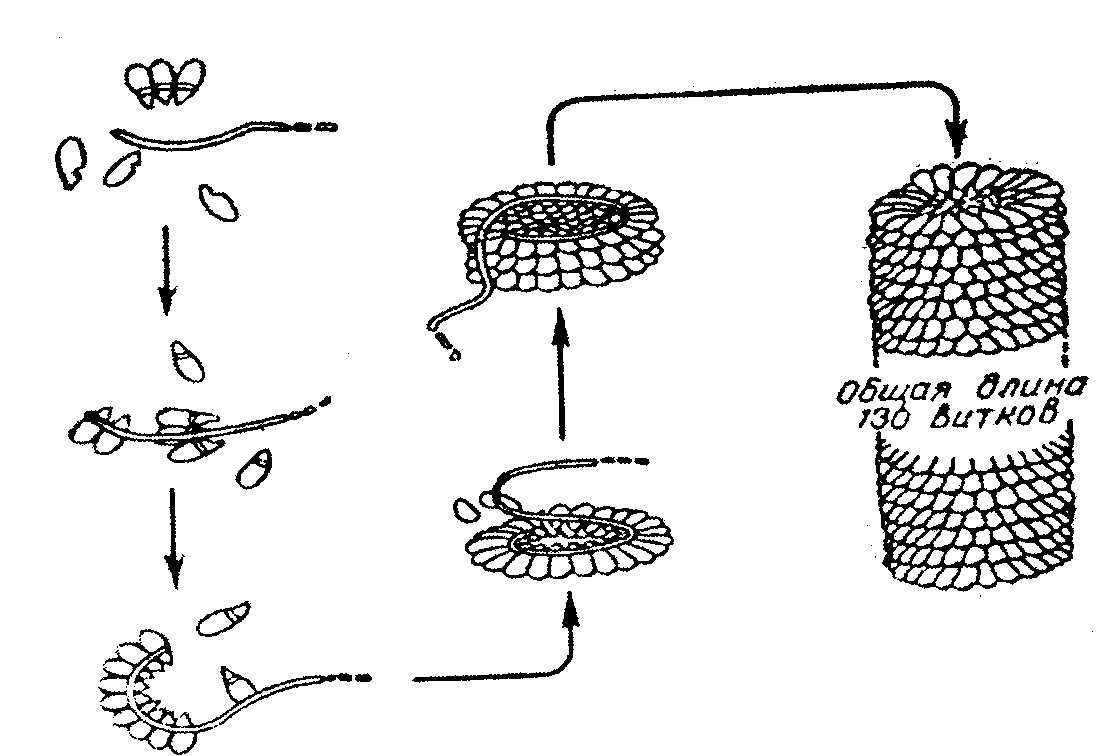
Ris. 2.9. Självmontering av tobaksmosaikviruset.
Mikrotubuli finns i alla celler. De bryts ständigt ned, omformas sedan, deltar i den intracellulära transporten av ämnen, i kromosomernas rörelse under celldelning. De är byggda av tubulin, som består av två peptider med Mm 111500 Da. De kan isoleras från celler; under inverkan av Mg 2+ bildas mikrotubuli.
Ribosomer, cellmembran bildas också av flera polypeptider (protomerer), som staplas inbördes och skapar en kvartär struktur.
I mitten av 80-talet upptäcktes det att det finns en speciell kategori av proteiner i cellen, vars huvudsakliga funktion är att säkerställa den korrekta karaktären av veckningen av polypeptidkedjor till en naturlig struktur. Dessa proteiner kallas "molekylära chaperones". De består av polypeptider arrangerade i två sju-ledade ringar under varandra. I mitten av cylindern som är konstruerad på detta sätt finns en kavitet - en kanal (45 ångström i diameter), i vilken veckningen av polypeptidkedjan sker. Dessutom är foldasenzymer involverade i veckningen av proteinmolekylen, vilket katalyserar bildningen av disulfidbindningar och isomera transformationer av vissa stabila trans-peptidyl-prolylbindningar till den cis-konfiguration som krävs för funktionell aktivitet.
Hej mina kära läsare. Jag är med dig, Galina Baeva, och idag kommer vi att prata om strukturen och funktionerna hos proteinmolekyler.
Varför behövs det, detta protein? Kan vi klara oss utan det?
Nej, det gör vi inte. Den skäggige grundaren av den dialektiska materialismen, Friedrich Engels, sa: livet är ett sätt att existera för proteinkroppar. Med andra ord, protein är livet, det finns inget protein - tyvärr, ah. Normalt är protein 50%, de där. hälften av cellens torra massa, och från människokroppens torra massa sträcker de sig från 45% .
Strukturella egenskaper hos proteiner tillåter dem att visa sig olika egenskaper vad som bestämmer deras olika biologiska funktioner
Proteiner kallas annars för proteiner, de är en och samma.
Vad gör proteiner i kroppen?
- Proteiner är byggstenarna i vår kropp. De är strukturella element i cellmembran (lipoproteiner, glykoproteiner) och extracellulära strukturer. Kollagen bildar senor, det är också ansvarigt för hudens elasticitet, keratin bildar hår och naglar.
- Proteiner transporterar viktiga element genom hela kroppen. Hemoglobin transporterar syre från lungorna till alla organ och vävnader, och från dem tar det bort koldioxid, albuminprotein bär fettsyror och speciella proteiner bär kolesterol. Cellmembran innehåller proteiner som säkerställer överföringen av vissa ämnen och joner från cellen till det extracellulära utrymmet och vice versa.
- Hormoner - speciella ämnen som reglerar metaboliska processer - är av proteinkaraktär. Till exempel driver hormonet insulin socker från blodplasman in i cellerna.
- Proteiner skyddar kroppen från främmande ämnen. Gamma globuliner neutraliserar mikrober, interferoner undertrycker reproduktionen av virus. Fibrin slutar blöda.
- Proteiner ger sammandragning av motoriska muskler och andra sammandragande vävnader. Aktin och myosin är en del av kroppens muskler, troponin, tropomyosin - hjärtats muskler.
- Proteiner tar emot signaler från den yttre miljön och sänder kommandon till cellen. Under påverkan av miljöfaktorer ändrar signalproteiner sin tertiära struktur, vilket i sin tur utlöser en kedja av biokemiska processer. Det är så rhodopsin reagerar på ljus och omvandlar ljusenergi till elektrisk energi, som överförs via nervceller till hjärnan, där en visuell bild bildas.
- Proteiner är enzymer - katalysatorer, på grund av vilka förekomsten av biokemiska reaktioner är möjliga när låga temperaturer(37°C).
- Proteiner – regulatorer slår på och av cellgenerna och därigenom undertrycker eller aktiverar biokemiska processer.
- Proteiner ackumuleras som regel inte i kroppen, med undantag för äggalbumin och mjölkkasein. Det finns inga extra proteiner i kroppen. Men de kan kombineras med andra ämnen och spårämnen, vilket förhindrar att de tas bort från kroppen. Så ferritin bildar ett komplex med järn, frigörs under nedbrytningen av hemoglobin och återinkluderar det i biologiska processer.
- Proteiner kan ge energi. Vid nedbrytning av 1 g protein frigörs 4 kcal (17,6 kJ). Som energikälla används proteiner när andra, normativa källor – kolhydrater och fetter – är utarmade. För att parafrasera D.I. Mendeleev kan vi säga att att drunkna med proteiner är som att drunkna med sedlar, de är så värdefulla för kroppen.
Vad är livets molekyl?
Detta är en lång kedja, d.v.s. polymer, bestående av monomerer - aminosyror. Varför aminosyror? Eftersom varje molekyl har en C-O-OH organisk syrasvans och en NH 2 aminogrupp. I polymerkedjan fäster varje aminosyramonomer sin syrarest till aminogruppen i en annan monomer, vilket resulterar i en stark bindning som kallas peptid.
Begreppen protein och peptid är nära, men inte likvärdiga. Peptider hänvisas vanligtvis till som en viss sekvens av aminosyrarester. Oligopeptider är isolerade - korta kedjor med 10-15 aminosyror och polypeptider - långa kedjor av aminosyrasekvenser. Ett protein är en polypeptid som har en speciell form av rumslig organisation.

Genom att stränga aminosyror som pärlor i ett halsband, en primär struktur hos ett protein de där. sekvens av aminosyrarester.\
I rymden finns inte proteinet i form av en långsträckt tråd, utan krullar i en spiral, d.v.s. former sekundär struktur.

Spiralen förvandlas till en boll - en kula, det här är redan tertiär struktur av proteinet.
Vissa proteiner (inte alla) har kvartär struktur, som i sin sammansättning kombinerar flera molekyler, var och en med sin egen primära, sekundära och tertiära struktur.
Varför behöver du veta? Eftersom smältningen och assimileringen av protein direkt beror på dess struktur: ju tätare proteinet är packat i livsmedelsproduktens sammansättning, desto svårare är det att smälta, desto mer energi måste läggas på dess assimilering.
Nedbrytningen av bindningar i en proteinmolekyl kallas denaturering. Denaturering kan vara reversibel, när proteinet återställer strukturen, och irreversibel. Proteiner genomgår irreversibel denaturering, även när de utsätts för höga temperaturer - för en person är det över 42 0 C, vilket är anledningen till att feber är livshotande.
Vi utsätter proteiner för kontrollerad denaturering under tillagningsprocessen, när vi lagar kött eller fisk, kokar mjölk, steker eller kokar ägg, kokar spannmål och bakar bröd. Med mild temperaturexponering blir proteiner med brutna bindningar mer tillgängliga för matsmältningsenzymer och absorberas bättre av kroppen. Vid långvarig och hård temperaturexponering - stekning på kol, långvarig tillagning - sker sekundär denaturering av proteinet med bildandet av svårsmälta föreningar.
Aminosyror
Det finns mer än tvåhundra olika aminosyror, men bara tjugo finns ständigt i sammansättningen av proteiner - polymerer. Dessa 20 "magiska" aminosyror är indelade i två olika grupper: icke-essentiella, dvs. de som kan produceras av kroppen själv, och oersättliga (nödvändiga), de produceras inte av människokroppen, och vi måste nödvändigtvis ta emot dem med mat.
Icke-essentiella aminosyror inkluderar: alanin, arginin, aspargin, asparaginsyra, glycin, glutamin, glutaminsyra, prolin, serin, tyrosin, cystin.
Essentiella aminosyror: Valin, Isoleucin, Leucin, Lysin, Metionin, Trionin, Tryptofan, Fenylalanin
För barn är essentiella aminosyror arginin och histidin.
Aminosyror kommer att vara ett separat inlägg.
Proteinklassificering
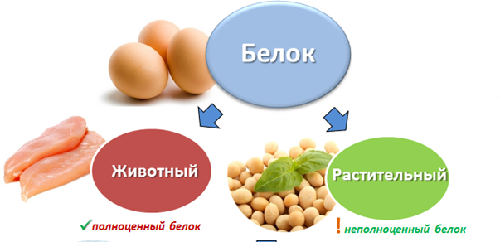
Ett komplett protein innehåller alla nödvändiga aminosyror i sin sammansättning, och ett ofullständigt protein innehåller följaktligen inga aminosyror.
För konstruktionen av alla kroppsproteiner är det viktigt inte bara närvaron av alla aminosyror, utan också deras proportioner i livsmedelsprodukten. Den mat som ligger närmast människokroppens proteiner i aminosyrasammansättning är optimal. Om en aminosyra saknas kan andra aminosyror inte användas av kroppen, dessutom kommer deras egna proteiner att börja brytas ned för att kompensera för bristen, främst proteiner - enzymer involverade i biosyntesprocesser och muskelproteiner. Under förhållanden med en brist på en eller annan essentiell aminosyra visar sig andra aminosyror vara överdrivna, även om detta överskott är relativt. Nedbrytande muskelproteiner bildar mycket giftiga metaboliska produkter och utsöndras intensivt av kroppen och skapar negativ kvävebalans. En person börjar bli svag, även om han uppriktigt kan tro att allt är i sin ordning med hans näring.
Beroende på deras ursprung delas proteiner in i animaliskt och vegetabiliskt.
Animaliska proteiner inkluderar proteiner från ägg, mjölk och mejeriprodukter, fisk och skaldjur, kött från djur och fåglar.
Vegetabiliska proteiner inkluderar proteiner från spannmål, baljväxter, nötter och svamp.
Mat anses vara protein om det innehåller minst 15 % protein.
Alla animaliska proteiner är kompletta, d.v.s. innehåller en komplett uppsättning aminosyror. De flesta växtproteiner är ofullständiga.
Med otillräckligt intag av protein från mat utvecklas degenerativa processer i kroppen i samband med oförmågan att utföra de nödvändiga funktionerna. Först och främst lider immuniteten. En person blir predisponerad för virus- och bakterieinfektioner, sjukdomar blir utdragna, kroniska. Håret börjar falla av, huden blir slapp, skrynklig. Den viljemässiga sfären lider, apati täcker en person, fullständig ovilja att göra något, depression ansluter sig. Minskar muskelmassaämnesomsättningen saktar ner. Matsmältningsproblem börjar, den sk. "irritable bowel syndrome", när ätandet åtföljs av flatulens, ersätts diarré av förstoppning och vice versa. Betryckt barnafödande funktion kvinnor slutar menstruera. I svåra fall börjar strukturella förändringar i organ och vävnader, synlig utmattning. Proteinsvält hos barn leder till utvecklingsstörd.
Allvarlig proteinsvält i vår tid i civiliserade länder, där vi inkluderar vårt land, om vi utesluter sjukdomar som tuberkulos eller onkologi, förekommer hos människor som utövar galna svältdieter i en manisk önskan att gå ner i vikt.
Det sista meddelandet gällde Angelina Jolie, hon var inlagd på sjukhus med en vikt på 35 kg - så här hittade de sovjetiska befriarna av nazistiska koncentrationslägerfångar. Det är osannolikt att levande skelett var exempel på skönhet.
Brist på protein är dock inte ett så ovanligt tillstånd, på grund av ett ohälsosamt kostmönster som har utvecklats på grund av de relativt höga kostnaderna för proteinprodukter. I ett försök att spara pengar byter folk till en kolhydrat-fettdiet med konsumtion av defekt vegetabiliskt protein. Halvfabrikat tillverkade av surrogat och icke-proteinprodukter gör sitt bidrag. Så en person som köper färdiga kotletter, korvar, korvar kan uppriktigt tro att han konsumerar tillräckligt med protein. Gör inga misstag.
I nästa artikel kommer du att lära dig hur mycket och vilken typ av protein en person behöver för att hålla sig frisk.
Lämna kommentarer, dela information i i sociala nätverk. Galina Bayeva.
Proteiner är ett av de viktiga organiska delarna i alla levande celler i kroppen. De utför många funktioner: stödjande, signalerande, enzymatiska, transporterande, strukturella, receptorer etc. Primära, sekundära, tertiära och kvartära strukturer har blivit viktiga evolutionära anpassningar av dessa molekyler? Varför är rätt konformation av proteiner i kroppens celler så viktig?
Strukturella komponenter i proteiner
Monomererna i vilken polypeptidkedja som helst är aminosyror (AA). Dessa lågmolekylära organiska föreningar är ganska vanliga i naturen och kan existera som oberoende molekyler som utför sina egna funktioner. Bland dem är transport av ämnen, mottagning, hämning eller aktivering av enzymer.
Totalt finns det cirka 200 biogena aminosyror, men endast 20 av dem kan vara proteinmonomerer. De löser sig lätt i vatten, har en kristallin struktur och många av dem är söta i smaken.
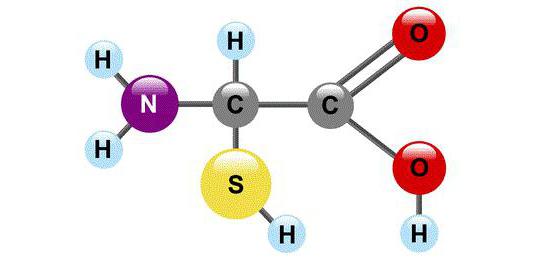
Ur kemisk synvinkel är AA molekyler som nödvändigtvis innehåller två funktionella grupper: -COOH och -NH2. Med hjälp av dessa grupper bildar aminosyror kedjor som förbinds med varandra genom en peptidbindning.
Var och en av de 20 proteinogena aminosyrorna har sin egen radikal, beroende på vilken Kemiska egenskaper. Enligt sammansättningen av sådana radikaler klassificeras alla AA i flera grupper.
- Icke-polär: isoleucin, glycin, leucin, valin, prolin, alanin.
- Polär och oladdad: treonin, metionin, cystein, serin, glutamin, asparagin.
- Aromatisk: tyrosin, fenylalanin, tryptofan.
- Polär och negativt laddad: glutamat, aspartat.
- Polär och positivt laddad: arginin, histidin, lysin.
Alla nivåer av organisation av proteinstrukturen (primär, sekundär, tertiär, kvartär) är baserad på en polypeptidkedja bestående av AA. Den enda skillnaden är hur denna sekvens bildas i rymden och med hjälp av vilka kemiska bindningar en sådan konformation upprätthålls.
Primär struktur av ett protein
Alla proteiner bildas på ribosomer - icke-membrancellsorganeller som är involverade i syntesen av polypeptidkedjan. Här är aminosyror kopplade till varandra med hjälp av en stark peptidbindning, vilket bildar en primär struktur. En sådan primär struktur hos ett protein är dock extremt olik den kvartära, så ytterligare mognad av molekylen är nödvändig.
Proteiner som elastin, histoner, glutation, redan med en så enkel struktur, kan utföra sina funktioner i kroppen. För de allra flesta proteiner är nästa steg bildandet av en mer komplex sekundär konformation.

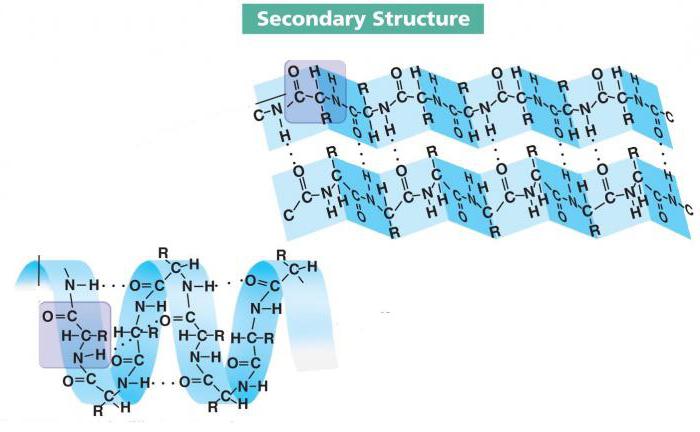
Sekundär struktur av ett protein
Bildandet av peptidbindningar är det första steget i mognaden av de flesta proteiner. För att de ska kunna utföra sina funktioner måste deras lokala konformation genomgå vissa förändringar. Detta uppnås med hjälp av vätebindningar - bräckliga, men samtidigt många kopplingar mellan aminosyramolekylernas bas- och syracentra.
Det är så proteinets sekundära struktur bildas, som skiljer sig från den kvartära i sin enkelhet i konfiguration och lokal konformation. Det senare gör att inte hela kedjan utsätts för transformation. Vätebindningar kan bildas på flera ställen med olika avstånd från varandra, och deras form beror också på typen av aminosyror och sättet för montering.
Lysozym och pepsin är representanter för proteiner som har en sekundär struktur. Pepsin är involverat i matsmältningsprocesserna, och lysozym utför en skyddande funktion i kroppen och förstör bakteriers cellväggar.
Funktioner i den sekundära strukturen
Lokala konformationer av peptidkedjan kan skilja sig från varandra. Flera dussin har redan studerats, och tre av dem är de vanligaste. Bland dem finns alfahelix, beta-lager och beta-turn.
- Alfahelixen är en av de vanligaste sekundära strukturkonformationerna för de flesta proteiner. Det är en styv stångram med en slaglängd på 0,54 nm. Aminosyraradikaler är riktade utåt.
Högerhänta spiraler är vanligast, och vänsterhänta motsvarigheter kan ibland hittas. Formningsfunktionen utförs av vätebindningar, som stabiliserar lockarna. Kedjan som bildar alfahelixen innehåller väldigt lite prolin och polärt laddade aminosyror.
- Beta-svängen är isolerad i en separat konformation, även om detta kan kallas en del av betaarket. Summan av kardemumman är böjningen av peptidkedjan, som stöds av vätebindningar. Vanligtvis består platsen för själva böjningen av 4-5 aminosyror, bland vilka närvaron av prolin är obligatorisk. Denna AK är den enda som har ett styvt och kort skelett, vilket gör att du själv kan bilda en sväng.
- Betaskiktet är en kedja av aminosyror som bildar flera veck och stabiliserar dem med vätebindningar. Denna konformation är mycket lik ett pappersark vikt till ett dragspel. Oftast har aggressiva proteiner denna form, men det finns många undantag.
Det finns parallella och antiparallella betalager. I det första fallet sammanfaller C- och N-ändarna vid krökarna och i ändarna av kedjan, men i det andra fallet inte.
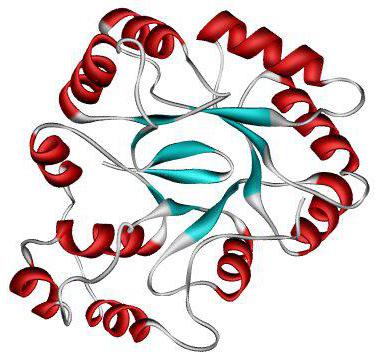
Tertiär struktur
Ytterligare packning av proteinet leder till bildandet av en tertiär struktur. Denna konformation stabiliseras med hjälp av väte, disulfid, hydrofoba och jonbindningar. Deras stora antal gör att den sekundära strukturen kan vridas till en mer komplex form och stabiliseras.
De är åtskilda av globulära och globulära peptider Molekylen av globulära peptider är en sfärisk struktur. Exempel: albumin, globulin, histoner i tertiär struktur.
Starka trådar bildas, vars längd överstiger deras bredd. Sådana proteiner utför oftast strukturella och formande funktioner. Exempel är fibroin, keratin, kollagen, elastin.
Strukturen av proteiner i molekylens kvartära struktur
Om flera kulor kombineras till ett komplex bildas den så kallade kvartära strukturen. Denna konformation är inte karakteristisk för alla peptider, och den bildas när det är nödvändigt att utföra viktiga och specifika funktioner.
Varje kula i kompositionen är en separat domän eller protomer. Tillsammans kallas molekylerna en oligomer.
Vanligtvis har ett sådant protein flera stabila konformationer som ständigt ersätter varandra, antingen beroende på påverkan av vissa yttre faktorer eller när det är nödvändigt att utföra olika funktioner.
En viktig skillnad mellan den tertiära och kvartära strukturen hos ett protein är intermolekylära bindningar, som är ansvariga för att koppla ihop flera kulor. I mitten av hela molekylen finns ofta en metalljon, som direkt påverkar bildandet av intermolekylära bindningar.
Ytterligare proteinstrukturer
Det räcker inte alltid med en kedja av aminosyror för att utföra ett proteins funktioner. I de flesta fall är andra ämnen av organisk och oorganisk natur fästa vid sådana molekyler. Eftersom denna egenskap är karakteristisk för de allra flesta enzymer, är sammansättningen av komplexa proteiner vanligtvis uppdelad i tre delar:
- Ett apoenzym är en proteindel av en molekyl, som är en aminosyrasekvens.
- Koenzym är inte ett protein, utan en organisk del. Det kan inkludera olika typer av lipider, kolhydrater eller till och med nukleinsyror. Detta inkluderar representanter för biologiskt aktiva föreningar, bland vilka det finns vitaminer.
- Kofaktor - en oorganisk del, representerad i de allra flesta fall av metalljoner.
Strukturen av proteiner i en molekyls kvartära struktur kräver deltagande av flera molekyler olika ursprung, så många enzymer har tre komponenter samtidigt. Ett exempel är fosfokinas, ett enzym som säkerställer överföringen av en fosfatgrupp från en ATP-molekyl.
Var bildas den kvartära strukturen hos en proteinmolekyl?
Polypeptidkedjan börjar syntetiseras på cellens ribosomer, men ytterligare mognad av proteinet sker i andra organeller. Den nybildade molekylen måste komma in i transportsystemet, som består av kärnmembranet, ER, Golgi-apparaten och lysosomer.
Komplikationen av proteinets rumsliga struktur inträffar i det endoplasmatiska retikulumet, där inte bara olika sorter bindningar (väte, disulfid, hydrofoba, intermolekylära, joniska), men ett koenzym och en kofaktor förenas också. Det är så proteinets kvartära struktur bildas.
När molekylen är helt redo för arbete går den in i antingen cellens cytoplasma eller Golgi-apparaten. I det senare fallet packas dessa peptider i lysosomer och transporteras till andra avdelningar i cellen.
Exempel på oligomera proteiner
Den kvartära strukturen är strukturen hos proteiner, som är utformad för att bidra till att vitala funktioner utförs i en levande organism. Den komplexa konformationen av organiska molekyler gör det först och främst möjligt att påverka arbetet i många metaboliska processer (enzymer).
Biologiskt viktiga proteiner är hemoglobin, klorofyll och hemocyanin. Porfyrinringen är grunden för dessa molekyler, i mitten av dessa finns en metalljon.
Hemoglobin
Den kvartära strukturen hos hemoglobinproteinmolekylen består av 4 kulor sammankopplade med intermolekylära bindningar. I mitten finns en porfin med en järnjon. Proteinet transporteras i erytrocyternas cytoplasma, där de upptar cirka 80 % av cytoplasmans totala volym.
Grunden för molekylen är hem, som har en mer oorganisk natur och är färgad röd. Det är också den primära nedbrytningsprodukten av hemoglobin i levern.
Vi vet alla att hemoglobin utför en viktig transportfunktion - överföringen av syre och koldioxid i hela människokroppen. Den komplexa konformationen av en proteinmolekyl bildar speciella aktiva centra, som kan binda motsvarande gaser till hemoglobin.
När ett protein-gaskomplex bildas bildas så kallat oxyhemoglobin och karbohemoglobin. Det finns dock en annan typ av sådana föreningar som är ganska stabila: karboxihemoglobin. Det är ett komplex av protein och kolmonoxid, vars stabilitet förklarar attackerna av kvävning med överdriven toxicitet.

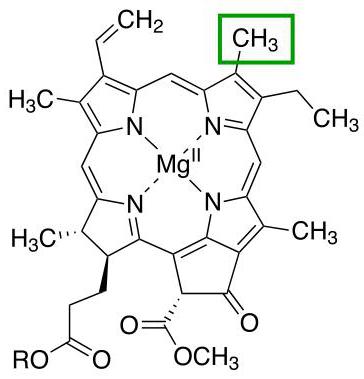
Klorofyll
En annan representant för proteiner med en kvartär struktur, vars domänbindningar redan stöds av en magnesiumjon. Huvudfunktionen för hela molekylen är deltagande i processerna för fotosyntes i växter.
Det finns olika typer av klorofyll som skiljer sig från varandra genom radikalerna i porfyrinringen. Var och en av dessa sorter är märkt med en separat bokstav i det latinska alfabetet. Till exempel kännetecknas landväxter av närvaron av klorofyll a eller klorofyll b, medan alger också har andra typer av detta protein.
Hemocyanin
Denna molekyl är en analog av hemoglobin i många lägre djur (leddjur, blötdjur, etc.). Den största skillnaden i strukturen hos ett protein med en kvartär molekylstruktur är närvaron av en zinkjon istället för en järnjon. Hemocyanin har en blåaktig färg.
Ibland undrar folk vad som skulle hända om vi ersatte humant hemoglobin med hemocyanin. I det här fallet är det vanliga innehållet av ämnen i blodet, och i synnerhet aminosyror, stört. Hemocyanin är också instabilt för att bilda ett komplex med koldioxid, så "blått blod" skulle ha en tendens att bilda blodproppar.
För mer än 4 miljarder år sedan, på jorden, från små oorganiska molekyler, uppstod proteiner på ett obegripligt sätt, som blev byggstenarna i levande organismer. Alla levande varelser har sin oändliga mångfald att tacka just de unika proteinmolekylerna, och andra former av liv i universum är fortfarande okända för vetenskapen.
Proteiner, eller proteiner (från grekiskan "protos" - "första"), är naturliga organiska föreningar som tillhandahåller alla livsprocesser för alla organismer. Ögats och nätets lins, sköldpaddsskalet och giftiga ämnen svamp... Med hjälp av proteiner smälter vi mat och bekämpar sjukdomar. Tack vare speciella proteiner lyser eldflugor på natten, och i havets djup blinkar maneter med ett mystiskt ljus.
Det finns många gånger fler proteinmolekyler i en levande cell än alla andra (förutom vatten förstås!). Forskare har funnit att i de flesta organismer utgör proteiner mer än hälften av deras torra massa. Och mångfalden av proteintyper är mycket stor - i en cell av en så liten organism som bakterien Escherichia soy" (se den extra uppsatsen "Studieobjektet är prokaryoter"), finns det cirka 3 tusen olika proteiner.
Protein isolerades först (i form av gluten) 1728 av italienaren Jacopo Bartolomeo Beccari (1682-1766) från vetemjöl. Denna händelse anses vara födelsen av proteinkemin. Sedan dess, under nästan tre århundraden, har tusentals olika proteiner erhållits från naturliga källor och deras egenskaper har undersökts.
BIOLOGISKA "PÄRLOR"
Proteinmolekylen är mycket lång. Kemister kallar sådana molekyler polymera (från grekiskan "poly" - "många" och "meros" - "del", "andel"). En lång polymermolekyl består faktiskt av många små molekyler kopplade till varandra. Så här träs pärlor på en tråd i ett halsband. I polymerer spelas en tråds roll av kemiska bindningar mellan pärlmolekylerna.
Hemligheten med proteiner är gömd i egenskaperna hos samma pärlor. De flesta polymerer tar inte en stabil form i rymden och blir som samma pärlor som inte kan ha en rumslig struktur: om du hänger dem runt halsen kommer de att ta formen av en ring eller en oval, om du lägger dem i en låda , kommer de att krypa ihop till en boll av obestämd form. Och låt oss nu föreställa oss att vissa pärlor kan "hålla ihop" med varandra. Till exempel attraheras röda av gula. Då kommer hela kedjan att ta en viss form, på grund av dess existens "klibbar ihop" av gula och röda pärlor
Något liknande händer i proteiner. Separata små molekyler som utgör proteinet har förmågan att "hålla ihop", eftersom attraktionskrafter verkar mellan dem. Som ett resultat har vilken proteinkedja som helst en rumslig struktur som endast är karakteristisk för den. Det är hon som bestämmer proteiners underbara egenskaper. Utan en sådan struktur skulle de inte kunna utföra de funktioner som de utför i en levande cell.
Vid långvarig kokning av proteiner i närvaro av starka syror eller alkalier bryts proteinkedjorna upp i sina beståndsdelar,
kallas aminosyror. Aminosyror är "pärlorna" som utgör proteinet, och de är relativt enkla.
HUR EN AMINOSYRA ÄR DESIGNET
Varje aminosyramolekyl har en kolatom bunden till fyra substituenter. En av dem är en väteatom, den andra är en karboxylgrupp -COOH. Det "släpper" lätt vätejonen H +, på grund av vilket ordet "syra" finns i aminosyrornas namn. Den tredje substituenten är aminogruppen - NH 2 och slutligen är den fjärde substituenten en grupp atomer, som i allmänt fall beteckna R. Alla aminosyror har olika R-grupper, och var och en av dem spelar sin egen, mycket viktiga roll.
Egenskaperna hos "pärlor" som skiljer en aminosyra från en annan är dolda i R-grupper (de kallas även sidokedjor). När det gäller COOH-gruppen, behandlar organiska kemister den med stor respekt: alla andra kolatomer i molekylen ges beteckningar beroende på graden av avstånd från karboxylgruppen. Atomen närmast den kallas en a-atom, den andra kallas b-atom, nästa är en y-atom etc. Kolatomen i aminosyror, som ligger närmast karboxylgruppen, d.v.s. atom är också associerad med aminogruppen, så de naturliga aminosyrorna som proteinet består av kallas a-aminosyror.
I naturen finns det också aminosyror där NH^-gruppen är bunden till kolatomer längre bort från karboxylgruppen. Naturen valde dock a-aminosyror för att bygga proteiner. Detta beror främst på det faktum att endast a-aminosyror kopplade i långa kedjor kan ge tillräcklig styrka och stabilitet i strukturen hos stora proteinmolekyler.
Antalet a-aminosyror som skiljer sig i R-grupp är stort. Men oftare än andra finns bara 20 olika aminosyror i proteiner. De kan betraktas som alfabetet för proteinmolekylens "språk". Kemister kallar dessa huvudaminosyror standard, basisk eller normal. Konventionellt är de viktigaste aminosyrorna indelade i fyra klasser.
Den första inkluderar aminosyror med opolära sidokedjor. I den andra - aminosyror som innehåller en polär grupp. De följande två är aminosyror med sidokedjor som kan laddas positivt (de kombineras till en tredje klass) eller negativt (fjärde). Till exempel ger dissociationen av karboxylgruppen en anjon - COO-, och protoneringen av en kväveatom - en katjon, till exempel - NH3+. Sidokedjorna av asparaginsyra och glutaminsyra har vardera en karboxylgrupp till, COOH, som vid pH-värden som är typiska för en levande cell (pH = 7), bryts upp med en vätejon (H+) och får en negativ laddning. Sidokedjorna av aminosyrorna av lysin, arginin och histidin är positivt laddade, eftersom de har kväveatomer, som tvärtom kan fästa en vätejon.
Varje a-aminosyra (förutom glycin), beroende på det inbördes arrangemanget av de fyra substituenterna, kan existera i två former. De skiljer sig från varandra, som ett föremål från dess spegelbild, eller som en högerhand från en vänsterhand. Sådana föreningar kallas koral (från grekiskan "hir" - "hand"). Chirala molekyler upptäcktes 1848 av den store franske vetenskapsmannen Louis Pasteur. Två typer av optiska isomerer av organiska molekyler har fått namnen D-form (från latin dexter - "höger") och Z-form (från latin laevus - "vänster"). Förresten, ett av namnen på andra kirala molekyler - glukos och fruktos - är dextros och levulos. Det är anmärkningsvärt att endast Z-aminosyror ingår i sammansättningen av proteiner, och allt proteinliv på jorden är "vänster".
För normal funktion behöver kroppen en komplett uppsättning av 20 grundläggande a-Z-aminosyror. Men några av dem kan syntetiseras i själva organismens celler, medan andra måste komma i färdig form från livsmedelsprodukter. I det första fallet kallas aminosyror icke-essentiella, och i det andra - oumbärliga. Uppsättningen av den senare är olika för olika organismer. Till exempel är 10 aminosyror oumbärliga för en vit råtta och 16 för mjölksyrabakterier.Växter kan självständigt syntetisera en mängd olika aminosyror, skapa de som inte finns i proteiner.
För enkelhetens skull symboliseras de 20 huvudaminosyrorna med en eller de tre första bokstäverna i det ryska eller engelska namnet på aminosyran, till exempel alanin - Ala eller A, glycin - Gly eller G.
VAD ÄR PEPTID
En polymer proteinmolekyl bildas genom att sammanfogas till en lång kedja av aminosyrapärlor. De är uppträdda på en tråd av kemiska bindningar på grund av amino- och karboxylgrupperna som finns i alla aminosyror kopplade till a-kolatomen.
De föreningar som bildas som ett resultat av en sådan reaktion kallas peptider; (-CO- NH - grupperingen i dem är en peptidgrupp, och bindningen mellan kol- och kväveatomer är en peptidbindning (det kallas även en amidbindning). Genom att koppla aminosyror genom peptidbindningar kan man få peptider som består av av rester av väldigt många aminosyror. Sådana föreningar kallas polypeptider.Proteinmolekylens polypeptidstruktur bevisades 1902 av den tyske kemisten Emil Hermann Fischer.
Vid ändarna av aminosyrakedjan finns fria amino- och karboxylgrupper; dessa ändar av kedjan kallas N- och C-terminaler. Aminosyrarester i polypeptidkedjan numreras vanligtvis från N-terminalen.
Det totala antalet aminosyrarester i en proteinmolekyl varierar över ett mycket brett intervall. Så, humant insulin består av 51 aminosyrarester och ammande modersmjölkslysozym - av 130. Det finns 4 aminosyrakedjor i humant hemoglobin, som var och en är uppbyggd av cirka 140 aminosyror. Det finns proteiner som har nästan 3 tusen aminosyrarester i en enda kedja.
Molekylvikterna för proteiner sträcker sig från cirka 11 000 för små proteiner som består av 100 aminosyrarester till 1 miljon eller mer för proteiner med mycket långa polypeptidkedjor eller för proteiner som består av flera polypeptidkedjor.
Frågan uppstår: hur kan hela den enorma variationen av proteiner med olika funktioner och egenskaper skapas från bara 20 molekyler? Och svaret på denna naturens hemlighet är enkelt - varje protein har sin egen unika aminosyrasammansättning och en unik ordning av aminosyrakombinationer, som kallas proteinets primära struktur.
SPIRALER OCH LAGER
I början av 50-talet. 1900-talet Amerikanske kemisten Linus Carl Pauling (1901-1994), tilldelad Nobelpriset i naturforskning kemisk bindning och Robert Corey (1897-1971) föreslog att vissa delar av aminosyrakedjan i proteiner vrids till en spiral. Tack vare förbättringen av experimentella metoder (proteinernas struktur studeras med hjälp av röntgenstrålar) bekräftades efter några år denna lysande gissning.
Faktum är att polypeptidkedjor mycket ofta bildar en högerhänt helix. Detta är den första, lägsta nivån av rumslig organisation av proteinkedjor. Det är här de svaga interaktionerna av aminosyra "pärlor" börjar spela en roll: C \u003d 0-gruppen och N - H-gruppen från olika peptidbindningar kan bildas vätebindning mellan sig. Det visade sig att i spiralen som upptäcktes av Pauling och Corey bildas en sådan bindning mellan C = 0-gruppen i varje i:te aminosyran och N - H (i + 4)-gruppen i aminosyran, d.v.s. aminosyror är sammankopplade rester med fyra "pärlor" från varandra. Dessa vätebindningar stabiliserar en sådan helix som helhet. Hon fick namnet a.-spiral.
Senare visade det sig att a-helixen inte är det enda sättet att vika aminosyrakedjor. Förutom spiraler bildar de också lager. Tack vare samma vätebindningar mellan C = 0 och N - H-grupperna kan flera olika fragment av en polypeptidkedja "klistra ihop" med varandra på en gång. Som ett resultat erhålls ett helt lager - det kallades ^-lagret.
I de flesta proteiner är a-helixar och p-lager varvat med alla möjliga veck och kedjefragment utan någon bestämd struktur. När man har att göra med den rumsliga strukturen av enskilda sektioner av proteinet talar de om proteinmolekylens sekundära struktur.
PROTEIN I RYMMEN
För att få ett komplett "porträtt" av en proteinmolekyl räcker det inte med kunskap om den primära och sekundära strukturen. Denna information ger ännu ingen uppfattning om vare sig volymen eller formen på molekylen, än mindre platsen för kedjesektionerna i förhållande till varandra. Men alla spiraler och lager är på något sätt placerade i rymden. Den allmänna rumsliga strukturen för polypeptidkedjan kallas proteinets tertiära struktur.
De första rumsliga modellerna av proteinmolekyler - myoglobin och hemoglobin - byggdes i slutet av 50-talet. 1900-talet De engelska biokemisterna John Coudery Kendrew (född 1917) och Max Ferdinand Perutz (född 1914). Därvid använde de data från experiment med röntgenstrålar. För forskning inom området proteiners struktur tilldelades Kendrew och Perutz Nobelpriset 1962. Och i slutet av århundradet bestämdes den tertiära strukturen av redan flera tusen proteiner.
När proteinets tertiära struktur bildas visar R-grupperna, aminosyrornas sidokedjor, slutligen aktivitet. Det är tack vare dem som de flesta av "pärlorna"-aminosyrorna "håller ihop" sinsemellan, vilket ger kedjan en viss form i rymden.
I en levande organism finns proteiner alltid i vattenmiljön. Och det största antalet grundläggande aminosyror - åtta - innehåller opolära R-grupper. Naturligtvis tenderar proteinet att på ett tillförlitligt sätt dölja opolära sidokedjor inuti sin molekyl för att begränsa deras kontakt med vatten. Forskare kallar detta uppkomsten av hydrofoba interaktioner (se artikeln "Livets minsta enhet").
På grund av hydrofoba interaktioner tar hela polypeptidkedjan en viss form i rymden, dvs bildar en tertiär struktur.
Andra krafter verkar också i proteinmolekylen. Vissa av sidokedjorna i huvudaminosyrorna är negativt laddade och några är positivt laddade. Eftersom negativa laddningar attraheras av positiva, "klibbar" motsvarande "pärlor" ihop. Elektrostatiska interaktioner, eller, som de annars kallas, saltbryggor, är en annan viktig kraft som stabiliserar den tertiära strukturen.
De sju grundläggande aminosyrorna har polära sidokedjor. Vätebindningar kan uppstå mellan dem, som också spelar en betydande roll för att upprätthålla proteinets rumsliga struktur.
Kovalenta bindningar (-S-S-) bildas ibland mellan två aminosyrarester av cystein, som mycket stadigt fixerar placeringen av olika delar av proteinkedjan i förhållande till varandra. Sådana bindningar kallas disulfidbryggor. Dessa är de mest icke-talrika interaktionerna i proteiner (i vissa fall är de i allmänhet frånvarande), men när det gäller styrka har de ingen motsvarighet.
DEN HÖGSTA NIVÅN AV RUMLIG ORGANISATION AV PROTEINER
En proteinmolekyl kan inte bestå av en, utan av flera polypeptidkedjor. Varje sådan kedja är en oberoende rumslig struktur - en underenhet. Till exempel består hemoglobinproteinet av fyra underenheter som bildar en enda molekyl, belägen vid hörn av en nästan vanlig tetraeder. Underenheter "klibbar" till varandra på grund av samma krafter som stabiliserar den tertiära strukturen. Dessa är hydrofoba interaktioner, saltbryggor och vätebindningar.
Om ett protein består av flera underenheter sägs det ha en kvartär struktur. En sådan struktur är högsta nivån organisering av proteinmolekylen. Till skillnad från tre första nivåer har inte alla proteiner en kvartär struktur. Ungefär hälften av de proteiner som är kända idag saknar det.
VARFÖR PROTEINER ÄR RÄDDA FÖR VÄRME
Bindningarna som stöder proteinets rumsliga struktur förstörs ganska lätt. Vi vet från barndomen att när ägg kokas förvandlas en genomskinlig äggvita till en elastisk vit massa och mjölk tjocknar när den syras. Detta sker på grund av förstörelsen av den rumsliga strukturen av albuminproteiner i äggvita och kasein (ogglat. caseus - "ost") i mjölk. Denna process kallas denaturering. I det första fallet orsakas det av uppvärmning och i det andra av en betydande ökning av surheten (som ett resultat av den vitala aktiviteten hos bakterier som lever i mjölk). Under denaturering förlorar proteinet sin förmåga att utföra sina inneboende funktioner i kroppen (därav namnet på processen: från latin denaturare - "beröva naturliga egenskaper"). Denaturerade proteiner absorberas lättare av kroppen, så ett av målen med värmebehandling av livsmedelsprodukter är denaturering av proteiner.
VARFÖR RYMLIG STRUKTUR BEHÖVS
I naturen händer nästan ingenting av en slump. Om proteinet har tagit en viss form i rymden, måste detta tjäna till att uppnå något mål. Faktum är att endast ett protein med en "korrekt" rumslig struktur kan ha vissa egenskaper, det vill säga utföra de funktioner i kroppen som är ordinerade för det. Och det gör han med hjälp av samma R-grupper av aminosyror. Det visar sig att sidokedjorna inte bara bibehåller den "korrekta" formen på proteinmolekylen i rymden. R-grupper kan binda andra organiska och oorganiska molekyler, delta i kemiska reaktioner, fungera till exempel som en katalysator.
Ofta behövs den mycket rumsliga organisationen av polypeptidkedjan bara "för att vid vissa punkter i rymden koncentrera den uppsättning sidokedjor som är nödvändiga för att utföra en viss funktion. Kanske inte en enda process i en levande organism går igenom detta utan deltagande av proteiner.
VAD ÄR ENZYMERS HEMLIGHET
Alla kemiska reaktioner som inträffar i cellen uppstår på grund av en speciell klass av proteiner - enzymer. Dessa är katalytiska proteiner. De har sin egen hemlighet, som gör att de kan arbeta mycket mer effektivt än andra katalysatorer, vilket påskyndar reaktionerna miljarder gånger.
Anta att flera vänner inte kan träffas på något sätt. Men så fort en av dem bjöd in vänner till en födelsedagsfest lät resultatet inte vänta på sig: alla var på samma plats vid utsatt tid.
För att mötet skulle äga rum var det nödvändigt att pusha vänner att ta kontakt. Enzymet gör detsamma. I dess molekyl finns så kallade bindningscentra. De innehåller "bekväma stolar" som är attraktiva för en viss typ av kemiska föreningar (och bara för dem!) - R-grupper som förbinder vissa sektioner av de reagerande ämnenas molekyler. Till exempel, om en av molekylerna har en opolär grupp, finns det hydrofoba sidokedjor i bindningscentret. Om det finns en negativ laddning i molekylen kommer R-gruppen med en positiv laddning att vänta på den i enzymmolekylen.
Som ett resultat binder båda reagensmolekylerna till enzymet och befinner sig i omedelbar närhet av varandra. Dessutom de grupper av dem som borde gå med kemisk reaktion, orienterad i rymden på det sätt som är nödvändigt för reaktionen. Nu tas enzymets sidokedjor, som spelar rollen som katalysatorer, över. I enzymet är allt "genomtänkt" på ett sådant sätt att R-grupp-katalysatorerna också är placerade nära händelseplatsen, som kallas det aktiva centret. Och efter slutförandet av reaktionen "släpper" enzymet produktmolekyler (se artikeln "Enzymer är en mästare på alla branscher").
VAR KOMMER IMMUNITETEN FRÅN
Proteiner utför många funktioner i kroppen; de skyddar till exempel celler från oönskade intrång, skyddar dem från skador. Speciella proteiner - antikroppar har förmågan att känna igen bakterier, virus, främmande polymermolekyler som har kommit in i celler och neutralisera dem.
Hos högre ryggradsdjur skyddar immunsystemet kroppen från främmande partiklar. Den är utformad på ett sådant sätt att kroppen, som invaderas av sådana "aggressorer" - antigener, börjar producera antikroppar. Antikroppsmolekylen är fast bunden till antigenet: antikroppar, liksom enzymer, har också bindningscentra. Aminosyrornas sidokedjor är placerade i centra på ett sådant sätt att antigenet som fallit i denna fälla inte längre kan fly från antikroppens "järntassar". Efter bindning till antikroppen drivs fienden ut från kroppen.
Du kan tränga in i kroppen en liten mängd av vissa polymermolekyler som är en del av de bakterier eller virus som orsakar en infektionssjukdom.
Motsvarande antikroppar kommer omedelbart att dyka upp i kroppen. Nu kommer den "riktiga" patogena mikroben som har kommit in i blodet eller lymfan omedelbart att attackeras av dessa antikroppar, och sjukdomen kommer att besegras. Detta sätt att bekämpa en infektion är inget annat än en vaccination som många inte älskar. Tack vare det förvärvar kroppen immunitet mot infektionssjukdomar.
VARFÖR FINNS JÄRN I HEMOGLOBIN
I naturen finns det proteiner som förutom aminosyror innehåller andra kemiska komponenter, som lipider, sockerarter, metalljoner. Vanligtvis spelar dessa komponenter en viktig roll i utförandet av proteinets biologiska funktion. Så överföringen av molekyler och joner från ett organ till ett annat utförs av transportproteiner av blodplasma. Hemoglobinproteinet (från grekiskan "heme" - "blod" och latinets globus - "boll", "boll") som finns i blodkroppar - erytrocyter (från grekiskan "erythros" - "röd" och "kitos" - " cell"), levererar syre från lungorna till vävnaderna. I hemoglobinmolekylen finns ett komplex av järnjonen Fe 24 "med en komplex organisk molekyl, kallad hem. Hemoglobin består av fyra proteinsubenheter, och var och en av dem innehåller en hem.
Järnjonen deltar direkt i bindningen av syre i lungorna. Så snart som syre tillsätts i åtminstone en av underenheterna, ändrar jonen själv omedelbart något sin plats i proteinmolekylen. Rörelsen av järn "provocerar" rörelsen av hela aminosyrakedjan i denna underenhet, som något omvandlar dess tertiära struktur.
En annan underenhet, som ännu inte har tillsatt syre, "känner" vad som hände med sin granne. Dess struktur börjar också förändras. Som ett resultat binder den andra subenheten syre lättare än den första. Tillsatsen av syre till de tredje och fjärde subenheterna sker med ännu mindre svårighet. Som du kan se hjälper underenheterna varandra i sitt arbete. För detta behöver hemoglobin en kvartär struktur. Kolmonoxid CO (i vardagsspråket kolmonoxid) binder till järn i hem hundratals gånger starkare än syre. Kolmonoxid är dödligt för människor, eftersom det berövar hemoglobin förmågan att fästa syre.
OCH MER PROTEINER...
De fungerar som näringsämnen. Frön från många växter (vete, majs, ris, etc.) innehåller matproteiner. De inkluderar också albumin - huvudkomponenten äggvita och kasein, huvudproteinet i mjölk. När proteinmat smälts i människokroppen sker hydrolys av peptidbindningar. Proteiner "demonteras" till individuella aminosyror, från vilka kroppen sedan "bygger" nya peptider eller använder dem för energi. Därav namnet:
Det grekiska ordet "peptos" betyder "smält". Intressant nog styrs hydrolysen av peptidbindningen också av proteiner - enzymer.
Delta i regleringen av cellulär och fysiologisk aktivitet. Dessa proteiner inkluderar många hormoner (från grekiskan "gormao" - "Jag inducerar"), såsom insulin, som reglerar glukosmetabolismen, och tillväxthormon.
De ger kroppen förmågan att ändra form och röra sig. Proteinerna aktin och myosin, som musklerna är uppbyggda av, är ansvariga för detta.
De utför stödjande och skyddande funktioner, fäster biologiska strukturer och ger dem styrka. Hud är nästan rent kollagenprotein, medan hår, naglar och fjädrar består av det sega, olösliga proteinet keratin.
VAD SKRIVS I GENERNA
Sekvensen av aminosyror i proteiner kodas av gener, som lagras och ärvs med hjälp av DNA-molekyler (se artiklarna "Bevarare av ärftlig information. DNA" och "Genuttryck"). Den rumsliga strukturen hos ett protein bestäms exakt av den ordning i vilken aminosyrorna är ordnade. Det visar sig att inte bara de primära utan också de sekundära, tertiära och kvartära strukturerna av proteiner utgör innehållet i ärftlig information. Följaktligen är de funktioner som utförs av proteiner genetiskt programmerade. En enorm lista över dessa funktioner gör att proteiner med rätta kan kallas livets huvudmolekyler. Därför är information om proteiner den ovärderliga skatten som överförs i naturen från generation till generation.
Människans intresse för dessa organiska föreningar bara ökar för varje år. Idag har forskare redan dechiffrerat strukturen hos många proteinmolekyler. De tar reda på funktionerna hos en mängd olika proteiner, de försöker bestämma förhållandet mellan funktioner och struktur. Genom att etablera likheter och skillnader i proteiner som utför liknande funktioner i olika levande organismer kan du tränga djupare in i evolutionens hemligheter.
AMINOSYROR - ÅLDERSINDIKATORER
D - och L -former av aminosyror har förmågan att mycket långsamt övergå i varandra. Under en viss (mycket lång) tidsperiod kan en ren D- eller I-form bli en blandning av lika stora mängder av båda formerna. En sådan blandning kallas raiemagom, och själva processen kallas raie-mizaiiya. Racemiseringshastigheten beror på temperaturen och typen av aminosyra. Denna egenskap kan användas för att bestämma åldern på fossila rester av organismer, och, om nödvändigt, av levande varelser. Till exempel, i proteinet i dentin (dentin är benvävnaden i tänderna), bildas 1-ac-partinsyra spontant med en hastighet av 0,1 % per år. Hos barn under tandbildningsperioden innehåller dentinet endast 1-asparaginsyra. Dentin isoleras från tanden och halten av 0-formen bestäms i den. Testresultaten är ganska exakta. Så, för en 97-årig kvinna, vars ålder var dokumenterad, visade testet en ålder av 99 år. Data från studier gjorda på fossila rester av förhistoriska djur - elefanter, delfiner, björnar - stämmer väl överens med dateringsresultaten som erhållits med radionuklidmetoden.
VARFÖR SÄNGARE FÅR NOBELPRISER
Under hydrolysen av proteiner till aminosyror (förstörelse av peptidbindningen med vatten) går information om sekvensen av deras anslutning förlorad. Därför trodde man länge att det är en helt hopplös uppgift att bestämma den primära strukturen för ett protein. Men på 50-talet. 1900-talet Den engelske biokemisten Frederick Sanger (född 1918) kunde dechiffrera sekvensen av aminosyror i insulinhormonets polypeptidkedjor. För detta arbete, som tog flera år att slutföra, tilldelades Sanger 1958 Nobelpriset i kemi (tjugo år senare fick han tillsammans med W. Gilbert andra priset för sitt bidrag till upprättandet av DNA:s primära struktur) .
Principerna för att bestämma aminosyrasekvensen, som först formulerades av Sanger, används fortfarande idag, dock med alla möjliga variationer och förbättringar. Proceduren för att fastställa den primära strukturen för ett protein är komplex och flerstegs: det finns ungefär ett dussin olika stadier i det. Först bryts proteinet ner till individuella aminosyror och deras typ och mängd i ett givet ämne bestäms. I nästa steg delas en lång proteinmolekyl inte längre helt, utan i fragment. Sedan, i dessa fragment, bestäms ordningen för anslutning av aminosyror, och separerar dem sekventiellt en efter en. Uppdelningen av proteinet i fragment sker på flera sätt, så att det finns överlappande sektioner i olika fragment. Efter att ha tagit reda på ordningen på aminosyrorna i alla fragment får de fullständig information om hur aminosyrorna finns i proteinet. I slutet av XX-talet. speciella enheter har skapats som automatiskt bestämmer sekvensen av aminosyror i en proteinmolekyl - sekvenserare (från den engelska sekvensen - "sekvens").
MJÖLK OCH MEJERIPRODUKTER
Mjölk är en kolloidal lösning av fett i vatten. Under ett mikroskop ser man tydligt att den är heterogen: fettkulor flyter i en färglös lösning (serum).
Komjölk innehåller vanligtvis 3 till 6 % fett (mest estrar av glycerol och mättad karboxylsyror- palmitinsyra, stearinsyra), cirka 3% av proteiner, och även kolhydrater, organiska syror, vitaminer och mineraler.
Kaseinproteinet i mjölk finns i en bunden form - fosfatgrupper som är kovalent bundna till aminosyran serin bildar salter med kalciumjoner. När mjölken surgörs förstörs dessa salter och kasein frigörs i form av en vit ostmassa. I den mänskliga magen, under verkan av speciella enzymer, sker en process som kallas "kaseincurdling". Klumpat kasein fälls ut och utsöndras långsammare från kroppen och absorberas därför mer fullständigt. Kasein är mycket näringsrikt:
Den innehåller nästan alla aminosyror en person behöver för att bygga sina egna proteiner. PÅ ren form det är ett smaklöst vitt pulver, olösligt i vatten. Utöver det innehåller mjölk även andra proteiner, såsom laktalbumin. När det kokas förvandlas detta protein till en olöslig form och bildar en karakteristisk vit film på ytan av kokt mjölk - skum.
Sockret laktos C^HdgO, som ingår i mjölk, isomeriseras till sackaros. I människokroppen, under inverkan av laktasenzymet, bryts detta socker ner till monosackariderna glukos och galaktos, som lätt absorberas. På grund av detta fyller till exempel spädbarn på kolhydratlagren. Det är intressant att hos många människor (främst representanter för den mongoloida rasen) förlorar kroppen i vuxen ålder förmågan att bryta ner laktos.
När laktos passerar genom matsmältningskanalen absorberas inte laktos, utan blir en grogrund för utveckling av olika patogener, vilket leder till allmän sjukdomskänsla. Det är därför folket i Fjärran Östern (japanska, kinesiska) praktiskt taget inte använder mejeriprodukter i mat.
Under industriella förhållanden utsätts mjölk för värmebehandling, vars syfte är att undertrycka utvecklingen av mikroorganismer och förlänga dess hållbarhet. För att göra detta pastöriseras mjölk - hålls i 30 minuter vid 65 ° C, och kortvarig värmebehandling används också - uppvärmd i 10-20 s till 71 ° C. Jämfört med pastörisering bevarar värmebehandling näringsämnen, särskilt vitaminer, bättre. För att förhindra att mjölk separeras till grädde och vassle, homogeniseras den - den förs under tryck genom små hål. Fettkulor krossas, minskas i storlek och mjölken blir mer trögflytande.
En betydande del av mjölken går till bearbetning - för produktion av smör, ost och mejeriprodukter (kefir, jäst bakad mjölk, curdled mjölk, gräddfil).
För att få kefir fermenteras mjölk - hålls i 8-10 timmar vid 20-25 ° C, tillsätter ett frö av mjölksyrabakterier. Under deras verkan bryts laktos ner till mjölksyra:
С„н„о„ + n,о = laktos == 4CH3CH(OH)COOH. mjölksyra (2-hydroxipropansyra).
Det är mjölksyra som bestämmer den specifika smaken av kefir. När det ackumuleras i lösning sker koagulering (koagulering) av kasein, som frisätts i fri form. Därför har kefir en tjockare konsistens än mjölk. Mjölksyrajäsning av laktos åtföljs av alkoholjäsning, på grund av vilken i fermenterade mjölkprodukter, särskilt i kefir, finns det en liten mängd alkohol (upp till 0,03%). Fermenterade mjölkprodukter innehåller även mikroorganismer som hämmar utvecklingen av patogena bakterier och därmed förbättrar matsmältningen.
Keso erhålls också genom att jäsa mjölk med mjölksyrabakterier. Hans huvudsakliga integrerad delär proteinet kasein.
Att förbereda Smör, från vassle är det nödvändigt att separera fettdropparna som utgör mjölken. För att göra detta kärnas grädde - det övre, fetare skiktet som bildas under mjölksättningen.
Kasein finns också i ostar. De görs genom att tillsätta bakteriestarter och speciella enzymer till mjölk och sedan värma upp blandningen till en viss temperatur. Enzymer införs återigen i den frigjorda koageln och värms upp. I det här fallet finns det en partiell förändring av kaseinets struktur och sammansättning. Sedan läggs blandningen ut i formar och hålls under lång tid - upp till sex månader - vid en låg temperatur (inte högre än 15 ° C). Under mognad sönderfaller kasein under inverkan av enzymer till polypeptider och fria aminosyror. En del av aminosyrorna oxideras av atmosfäriskt syre, och ammoniak, aldehyder och även ketosyror bildas, vilket ger osten en karakteristisk smak.
Syrande mjölk är ett vanligt exempel på proteindenaturering.
KOPPARBLOD
I det kalla vattnet i den peruanska strömmen in Stilla havet bebodd av bläckfisken Dosidicus gigas. Dess cigarrformade kropp, tillsammans med tentakler, når en längd av 3,5 m, och massan på en jätte kan överstiga 150 kg. Kraftfulla möss kastar ut en vattenstråle med den kraft som den slår från en brandslang, tack vare vilken bläckfisken kan röra sig i hastigheter upp till 40 km/h. Med en mycket stark och vass näbb kan den bryta en stålkabel. Enligt ögonvittnen sliter bläckfisken bokstavligen en fisk på 20 kilo i strimlor. Detta våldsamma rovdjur är mycket farligt för människor. Frank Lanes bok The Kingdom of the Octopus säger att "en man som faller överbord på platser där många bläckfiskar lever kommer inte att leva i en halv minut."
För att "ladda" med energi behöver denna havsboende mycket syre - minst 50 liter per timme. Syre som kommer från havsvatten förs genom bläckfiskens kropp med hjälp av ett speciellt protein som innehåller koppar - hemianin (från grekiskan "hema" - "blod" och "kyanos" - "azurblå", "blå").
Det är värt att notera att i blodet hos ryggradsdjur "transporteras" syre av järnatomer i sammansättningen av hem, en speciell komplex molekyl som är en del av hemoglobinproteinet. De är bokstavligen fyllda med röda blodkroppar - erytrocyter. Hemoglobinmolekylen innehåller fyra hemfragment, som vart och ett kan binda en syremolekyl. Till skillnad från hemoglobin, i hemianin, är kopparatomer direkt associerade med proteinmolekyler som inte ingår i några celler, utan "svävar" fritt i blodet. Men en molekyl hemoiiani
Den kan binda upp till 200 kopparatomer. Och det finns ytterligare en egenskap hos hemoiiani-na - dess molekyler är enorma även för proteiner. De "vanliga" proteinerna som utgör ägg, mjölk, möss, molekylär massa varierar från 6 tusen till 1 miljon, och molekylvikten för hemianin kan nå 10 miljoner! Detta är ett av de största proteinerna; endast proteinkomplexen av virus är större i storlek och massa.
Hemoiyanin är en mycket gammal ekorre. Det är enklare än hemoglobin och inte lika effektivt. Ändå, med en låg syrehalt i havsvatten, förser hemianin ganska framgångsrikt vävnaderna hos kallblodiga djur med syre. Så syretrycket i hummerns gälar är bara 7 mm Hg. Konst. (930 Pa), och i vävnader - 3 mm Hg. Konst.; Dessutom är koncentrationen av denna gas i hummerns blod 20 gånger högre än i havsvatten.
Förutom bläckfiskar bärs syre av "blått blod" även i tiobenta kräftdjur (hummer, krabbor, räkor). Hemoiian finns hos alla bläckfiskar(bläckfisk, bläckfisk, bläckfisk), en mängd olika sniglar, spindlar, etc. Men pilgrimsmusslor, ostron och andra musslor är inte närvarande.
Mängden hemianin i blodet kan vara mycket olika. Så i den kvicka bläckfisken och hästskokrabban (ett marint djur av artropodtyp) når koncentrationen av detta ovanliga protein 10 g per 100 ml blod - nästan samma mängd hemoglobin i mänskligt blod. Samtidigt har den stillasittande ätbara blötdjursablonen Hatiotis tuberculata endast 0,03 g hemianin i 100 ml blod. Detta är förståeligt: ju aktivare djuret är,
Ju mer syre det behöver för att fylla på energikostnaderna, desto högre koncentration av syrebärande protein i blodet.
Hemoianin upptäcktes på 60-talet. XIX-talet, när biologer märkte att blodet hos bläckfiskar blir blått när de passerar genom gälarna. Och 1878 bevisade den belgiske fysiologen Leon Frederic att den blå färgen orsakas av reaktionen mellan syre och ett kopparinnehållande protein, som han kallade hemianin. När den senare tappar syre blir den, till skillnad från hemoglobin, färglös. Det är anmärkningsvärt att Frederick avslutade allt arbete med att studera det nya proteinet inom en dag.
Det är inte svårt att helt extrahera koppar från hemianin. Alya, det räcker att behandla proteinet i frånvaro av syre med ett reagens som binder starkt till monovalenta kopparjoner. På samma sätt kan du bestämma kopparhalten i hemianin. Berövad på denna metall förlorar den sin förmåga att transportera syre. Men om Cu-1-joner sedan införs i proteinlösningen återställer hemianin sin fysiologiska aktivitet.
Så det bevisades att i frånvaro av syre är kopparn av hemianin i +1 oxidationstillstånd. Med ett överskott av denna gas sker partiell oxidation av metallen. I det här fallet finns det alltid två kopparatomer per hemianinbunden syremolekyl. Således oxiderar syre exakt hälften av kopparatomerna. Detta är ytterligare en skillnad mellan hemianin och hemoglobin, som är mycket vanligare i djurriket, där alla järnatomer är lika och har en +2-laddning både i fritt tillstånd och i kombination med syre.