Historik referens
Sedan mitten av 1900-talet har installationer som drivs med kolvätegaser blivit allt vanligare i framdrivningssystem för tunga fordon och passagerarfordon. I slutet av århundradet och i början av 2000-talet blir sådana installationer nästan allestädes närvarande och börjar aktivt introduceras i produktion av stora fabriker, inte bara för bussar och lastbilar utan också för deras egna serier av personbilar, särskilt stadsjeepar och minivans, samt olika små hybridmodeller.
Anledningen till att man använder naturgas är ganska enkel - den är mer miljövänlig och billigare att använda än bensin. Inledningsvis var grunden för användningen av gasinstallationer just skyddet av miljön, med en ökning av kostnaden för olja och en motsvarande ökning av bensinpriserna blev den ekonomiska faktorn i användningen av gas HBO mer akut.
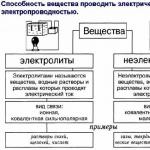
Valet av gas som sådant är förståeligt, men frågan uppstår vad som är bättre - propan eller metan. Att ge ett entydigt svar är att synda mot sanningen, men för ett medvetet beslut är det nödvändigt att känna till de användbara egenskaperna hos båda "sökande".
Propan
Propan tillhör klassen alkaner och är ett organiskt ämne som frigörs vid krackning (raffineringsprocessen) av petroleumprodukter, det kan även frigöras från naturgas. För att skapa en bränsleblandning blandas propan med etan och butan, i flytande tillstånd placeras den i cylindrar under ett tryck på 10-15 atmosfärer. Propan är en kolvätegas, den är tyngre än luft och explosiv när den finns i miljön i en mängd av 2,1 procent eller mer.
Propan är, i industriella termer, en produkt av separation av petroleum eller "fet" naturgas - det vill säga den har ett ganska högt innehåll av föroreningar, oljor, relaterade ämnen och behöver högkvalitativ rening och filtrering. Dessutom, enligt välkända studier, vid en tillräcklig koncentration kan propan ha en narkotisk effekt på människokroppen. Du kan se propan i vardagen i en vanlig gaständare.
Metan

Metan tillhör kategorin de enklaste kolvätena, det är mycket lättare än luft och nästan olösligt i vatten. Metan finns i stora underjordiska avlagringar, där det faktiskt utvinns i sin rena form, och sedan genomgår en filtreringsprocess, kompletterad med luktämnen för lukt. För användning som bränsle komprimeras metan till 200-250 atmosfärer, inrymd i en cylinder med ökad styrka och vanligtvis med en ganska hög vikt. Metanets explosivitet uppstår vid en koncentration över 4,4 procent i luften, medan det lätt förs bort av luftströmmar och bara kan samlas i slutna utrymmen.
Den främsta bekvämligheten med metan är dess låga pris. Dessutom är metan den renaste gasen som finns tillgänglig för användning i bränsleändamål, den innehåller nästan inga föroreningar och behöver bara den mest primitiva reningen. Samtidigt krävs en ganska dyr installation för metan, med hänsyn till särdragen för dess användning. Denna gas, liksom propan, har en narkotisk effekt på människokroppen, men obetydlig, på grund av dess sällsynta närvaro i luften. Du kan se metan i vardagen när du använder vilken hushållsgasspis som helst.
Jämförelse av metan och propan
Allmänna fördelar med gaser i bränsle
Båda gaserna har gemensamma fördelar jämfört med bensin, vilket gör att de kan utöka sin användning i framdrivningssystem år för år.
- Lägre pris i förhållande till bensin;
- Miljösäkerhet, mindre påverkan på människors hälsa;
- Ökad körtid utan tankning på grund av den större mängden bränsle som kan lagras;
- I komplexet bromsar slitaget av bildelar, speciellt när man använder en initialt anpassad motor.
Allmänna nackdelar med gaser i bränsle
Det finns också flera anledningar till att bensin fortfarande behåller sin ledande position som fordonsbränsle.
- Mindre tillgång på gaser för konsumenten (antal bensinstationer, såväl som bilservicecenter med gasinstallationer);
- Minskad fordonseffekt vid användning av gasbränsle;
- Ökat slitage på vissa särskilt känsliga områden av motorn (till exempel ventiler), med hänsyn till detaljerna för "torr förbränning" av gasbränsle.
De viktigaste skillnaderna mellan metan och propan
Metan och propan skiljer sig avsevärt från varandra både när det gäller lagringsdetaljerna och de specifika egenskaperna för användning som bränsle, var och en har sina egna fördelar och nackdelar.
- Enligt LPG - att komplettera en bilmotor med en propanenhet är betydligt (upp till 70%) billigare än att installera en metan LPG-enhet;
- Kostnadsmässigt - på lång sikt, efter att installationen av HBO lönar sig, ger metan höga besparingar på bränsle i förhållande till propan;
- Effektreduktion - propan, i förhållande till bensin, ger en liten effektminskning upp till 3-5% av motorn, och sedan vid en hastighet över 140 kilometer i timmen. Metan "försvagar bilen" upp till 20%. Men man bör komma ihåg att denna omständighet nästan utjämnades i moderna specialiserade installationer;
- Ekologisk renlighet - propan har föroreningar och anses inte vara helt säker för människor och miljö. Metan är det renaste bränslet på planeten, överträffar elmotorer och solpaneler i sin säkerhet, och är i nivå med alkoholinstallationer;
- Cylindrarnas vikt och bränslevolymen - propan, komprimerad under lågt tryck tillsammans med sin tank, väger flera gånger lättare än en cylinder med komprimerad metan. Samtidigt kan propan lagras en resa tre gånger längre än metan;
- Explosivitet – metan är hälften så explosivt som propan, och med tanke på spridning anses det vara det säkraste i förhållande till nästan alla andra bränslen. Det bör också noteras att metancylindrar under en olycka skadas och deformeras mycket mindre än propancylindrar. Därmed blir tillförseln av propan farligare i längden;
- Tillgänglighet på bensinstationer - metan-mackar är sällsynta, du måste leta efter dem, propan-mackar är nästan lika vanliga som bensinstationer. Samtidigt är utrustning för att komprimera, rengöra och fylla metan mycket mindre komplicerad än propan.
Tabell över fördelar och nackdelar med propan och metan
Att tanka gas kan vara bekvämare, mer ekonomiskt och funktionellt än att använda bensin, och du kan äntligen bestämma dig för valet av bekväm gas med hjälp av följande tabell.
| Faktor | Propan | Metan |
|---|---|---|
| HBO kostnad | Låg | Hög |
| Relativt billigare än bensin | 1,8-2 gånger | 3 gånger billigare |
| Förbrukning i förhållande till bensin (per 10 liter) | 11-11,5 liter | 8-8,5 kuber |
| Medium cylindervikt | 20-30 kg | 60-125 kg |
| Bränslekapacitet för en genomsnittlig uppsättning (kilometer tillryggalagd) | 600-1000 km | 250-350 km |
| Explosiv koncentration i luft | 2,1% | 4,4% |
| Skadlig effekt på motordelar | hög | låg |
| Kompression i ballongen | 10-15 atmosfärer | 200-250 atmosfärer |
| Miljösäkerhet | Hög | Komplett |
| Minskningen av motoreffekt i förhållande till bensin | 5% | 20-30% |
| Oktantal | 100 | 110 |
| Tillgång till bensinstation | Nästan lika med bensin | 1-2 per storstad |
Slutsats
Det slutliga valet är upp till bilisten - metan är säkrare och billigare, men dyrare att installera och använda, propan är vanligare, billigare att installera, cylindrar väger mindre, men det är explosivt och mer skadligt. Hur som helst förblir gastankning vid en bensinstation ett bekvämt och lovande alternativ till att tanka bensin, samtidigt som det är mer funktionellt än att köra på el eller alkohol.
I vatten
utbrott
spontan förbränning
Propan
Klorometan
2. Molekylens struktur
Molekylformel CH 4. Strukturella och elektroniska formler:
H | H-S-N | H
3. Kemiska egenskaper
Den första medlemmen av den homologa serien av mättade (metan) kolväten. Metan är ett kemiskt inaktivt ämne. Under normala förhållanden är den ganska resistent mot syror, alkalier och oxidationsmedel. Sålunda, när metan leds genom en KMnO 4-lösning, som är ett ganska starkt oxidationsmedel, oxiderar det inte och lösningens violetta färg försvinner inte. Metan går inte in i additionsreaktionen (meddelande) eftersom alla fyra valenser av kolatomen i sin molekyl är helt mättade. För metan, såväl som andra mättade kolväten, är substitutionsreaktioner typiska, där väteatomer ersätts med atomer av andra grundämnen eller atomgrupper. Utmärkande för metan är också en reaktion med klor, som sker vid vanliga temperaturer under påverkan av diffust ljus (en explosion kan inträffa i direkt solljus). I detta fall ersätts väteatomerna i metanmolekylen successivt med kloratomer
- CH4 + Cl2 \u003d CH3Cl + HCl
- CH 3 Cl + Cl 2 \u003d CH 2 Cl 2 + HCl
- CH 2 Cl 2 + Cl 2 \u003d CHCl 3 + HCl
- CHCI3 + Cl2 = CCI4 + HCl
Som ett resultat av reaktionen bildas en blandning av klorooidmetan.
I luft brinner metan med en färglös låga med frigörande av en betydande mängd värme:
- CH 4 + 2O 2 \u003d CO 2 + 2H 2 O
Metan bildar en brännbar explosiv blandning med luft. När metan värms upp utan lufttillgång till en temperatur över 1000 C, sönderdelas den till grundämnen - till kol (sot) och väte:
- CH 4 \u003d C + 2H 2
4. Utbredning i naturen
Metan är huvudkomponenten:
- naturliga brännbara gaser (upp till 99,5%),
- tillhörande olja (39-91%),
- träsk (99 %) och mina (34-48 %) gaser;
- finns i gaserna från lervulkaner (mer än 95 %),
- förekommer sporadiskt i vulkaniska gaser och i gaser från magmatiska och metamorfa bergarter.
En stor mängd metan löses i vattnet i haven, hav, sjöar. Det genomsnittliga innehållet av metan i världshavets vatten är cirka 10 -2 cm 3 / l, den totala mängden är 14,10 12 m 3. Mängden metan löst i formationsvatten är flera storleksordningar högre än dess industriella reserver.
Metan finns också i atmosfärerna på jorden, Jupiter, Saturnus, Uranus; i gaserna i Månens ytjord. Huvuddelen av metanet på sommaren och jordens hydrosfär bildades under den biokemiska och termiska katalytiska förstörelsen av dispergerat organiskt material, kol och olja. Metan bildas vid anaerob nedbrytning av organiskt material, särskilt cellulosa (metanjäsning).
I jordens natur är metan ganska vanligt. Brännbara naturgaser består av 90-97 % metan. Det bildar många fyndigheter, från vilka det utvinns och tillförs genom gasledningar till användningsplatsen. På botten av träsk och dammar bildas metan till följd av nedbrytning av växtrester utan lufttillgång. Därför kallas det också sumpgas. Under namnet firedamp ackumuleras metan i kolgruvor till följd av utsläpp från kollag och tillhörande bergarter, i vilka det finns i fri och bunden form. I gruvor i drift observeras metanutsläpp från kollag i mängden upp till 70-80 m / t s. b. m (t s. b. m. - ett ton torr askfri massa), vilket gör det ekonomiskt möjligt att självständigt eller åtföljande (avgasning) utvinning från kolfyndigheter.
Brandgas är mycket farligt eftersom det kan bilda en explosiv blandning med luft. De mest explosiva halterna av metan i luften är 9-14%.
Vid låga temperaturer bildar metan inklusionsföreningar - gashydrater, brett spridda i naturen.
Biobränslen WWVS Producentgaser Koks Motorbränslen
Energi Biofeedstock
Stora mängder metan används som ett bekvämt och billigt bränsle. Ofullständig förbränning av metan ger sot, som används för att göra tryckfärg och som fyllmedel för gummi, och vid termisk nedbrytning (över 1000 C) erhålls sot och väte, som används för syntes av ammoniak. Produkten av fullständig klorering av metan - koltetraklorid CCl 4 - är ett bra lösningsmedel för fetter och används för att extrahera fetter från oljeväxter. Metan fungerar också som utgångsmaterial för produktion av acetylen, metylalkohol och många andra kemiska produkter.
7. Metan som faktor vid kolproduktion
M. bildar explosiva blandningar med luft. När halten i luften är uppe i 5-6%, brinner M. nära en värmekälla (inflammationstemperatur 650-750 C), vid en halt av 5-15,2 (16)% - det exploderar, mer än 16% - det kan brinna med ett inflöde av syre, minska samtidigt koncentrationen M. explosiv. M. har en svag narkotisk effekt. MPC 300 mg / m 3. M:s tilldelning i gruvdrift skapar en speciell fara vid kolbrytning. Det finns tre former av M:s frisläppande i gruvan: vanlig, souffle och plötslig. Genom metanöverflöd, enligt "Säkerhetsreglerna i kol- och skiffergruvor", delas gruvor in i fem kategorier. Kriteriet för en sådan uppdelning är den relativa metanmängden, d.v.s. mängden metan i kubikmeter som frigörs per dag per 1 ton genomsnittlig daglig produktion: med metanutsläpp upp till 5 m 3 / t, 5 - 10 m 3 / t, 10 - 15 m 3 / t; superkategori - mer än 15 m 3 / t; farligt för souffärsekret. Gruvor som utvecklar sömmar som är farliga eller hotfulla på grund av plötsliga utbrott av kol, gas och berg tillhör en speciell kategori - farliga på grund av plötsliga utbrott. Utvinningen av metan från kollag anses lovande (se kollagens metanhalt, kolbäddsmetan). I slutet av nittonhundratalet. detta problem endast i USA behandlades av forskare ca. 40 universitet, ca. 100 företag. De första industriella försöken att använda tillhörande metan (vid kolbrytning) görs också i Ukraina, i Donbass. Inom industrin används metan för att producera syngas, acetylen, kloroform, koltetraklorid, kimrök m.fl.. Produkterna från den ofullständiga oxidationen av metan är utgångsmaterial för tillverkning av plaster som används i organisk syntes.
Se även
Källor
Metan är en organisk gas som är luktfri och färglös. CH 4 - detta är dess kemiska formel, och ämnets massa är mindre än luftmassan. Upplösning i vatten är långsam. På tal om metans organiska natur betyder det att nästan 95% av fallen av dess förekomst är av naturlig natur. Till exempel frigörs det vid nedbrytning av växtrester. Därför är det inte förvånande att många av dess egenskaper studerades redan före New Age, när människor observerade luftbubblor på ytan av stillastående vattenkroppar. Dessa bubblor var just den metan som frigjordes under förfallet av växter på botten av träsket.
Andra naturliga gaskällor inkluderar:
- Boskap. Bakterier som lever i deras magar avger metan under livets gång, och dess andel står för 20 % av all atmosfärisk gas.
- Växter. Metan är ett viktigt ämne som frigörs under fotosyntesen.
- Insekter. Termiter är de mest aktiva utsläpparna av metan.
- Gruvor. Under jordytan sker ständigt den långsamma nedbrytningen av kol, under vilken metan bildas.
- Oljebrunnar. Innehållet av denna gas i olja är helt enkelt enormt.
- Vulkaner. Förmodligen bildas även metan där på grund av att förhistoriskt organiskt material aktivt sönderfaller.
- Hav. Djupt under vattnet finns sprickor genom vilka metan kan sippra.
- Brinnande skogar.
- Industri. Trots den uppenbara aktiviteten hos dessa företag är deras andel av utsläppen av den totala massan försumbar.
Alla ovanstående exempel bekräftar tydligt det faktum att metan ständigt fanns i atmosfären, dess utseende är inte förknippat med början av aktiv mänsklig aktivitet. Det är därför närvaron av metan på planeten är ett tecken på att det kan finnas liv på den eller att det var där en gång.
Men den här gasens "naturlighet" betyder inte att den inte skadar oss. Dess ångor, särskilt vid höga koncentrationer, är ganska kapabla att leda till en persons död. I de tidiga stadierna av utvecklingen av gruvindustrin registrerades ofta explosioner eller allvarlig metanförgiftning av gruvarbetare. Om du följer informationen i media, så äger dessa händelser rum i den moderna världen. För att minimera risken för metanförgiftning, vid första tecken på det, bör du beställa en professionell analys av luften i rummet, med hjälp av vilken det kommer att vara möjligt att exakt bestämma koncentrationen.
Metan i den moderna världen
Gas används ofta i den moderna världen:
- Förbränningsmotorer arbetar ganska ofta på metan.
- Gas gör det möjligt att producera många läkemedel, inklusive antiseptika och sömntabletter.
- Metan är grunden för formaldehyd och metanol, som används för att göra konstgödsel och många andra ämnen.
- Utan metan är det omöjligt att tillverka brandsläckare och lösningsmedel.
- Blåvätesyra är inte bara ett gift, den finner också bred praktisk tillämpning, och dess tillverkningsprocess är baserad på oxidation av en metan- och ammoniakblandning.
Metan och dess fara för människokroppen
Faran med metan ligger i följande faktorer:
- Explosivitet. Det är denna egenskap som gav den namnet "explosiv gas". Ansamlingen av metan, den minsta gnistan - allt detta kan leda till en förödande explosion. Det är därför på platser där ansamlingar eller utsläpp av denna gas registreras, kan du inte röka, använd öppna eldkällor. Men ibland räcker inte ens dessa säkerhetsåtgärder, gasen fortsätter att ta människoliv.
- Vi har redan nämnt egenskapen som metan kan ansamlas i gruvor. Den kan främst hittas i tomrum mellan stora berglager, samt tomrum som skapas av gruvarbetare under gruvprocessen. Ju aktivare utvinningen är desto intensivare blir metanutsläppen, och därför är det gruvarbetarna som oftast dör av denna gas.
- Explosioner är inte hela faran, metan kan också orsaka allvarlig förgiftning. Inandning av stora volymer av det leder till brist på syre i blodet, "ringningar" i öronen, en känsla av ett "gjutjärn" huvud. En ökning av koncentrationen får hjärtat att slå snabbare, en person känner allmän svaghet, lider av illamående och huden kan bli röd. De allvarligaste konsekvenserna är svimning, blekhet, kramper och till och med döden.
- Tyvärr luktar inte metan i sin rena form, och därför är det svårt att upptäcka det. "Metan"-aromen som vi kan lukta är fördelen med speciella dofter som gör användningen säkrare och mer kontrollerbar.
- I gruvorna tillsätts förstås inga doftämnen till metanet. Sedan urminnes tider har människor använt speciella metoder för att registrera dess närvaro i luften. De första gruvarbetarna tog till exempel en kanariefågel med sig. Om fågeln slutade sjunga eller till och med dog, är det brådskande att lämna slakten.
- På 1950-talet började man använda speciella instrument för att exakt bestämma andelen metan i luftblandningen. Men erfarna arbetare sa att kanariefågel är ett ännu bättre sätt än nymodiga apparater. Naturligtvis är moderna enheter mer känsliga och kompakta, ibland är de monterade direkt i gruvarbetarnas hjälmar, som lampor. I gruvorna installeras även stationära sensorer som ständigt överför information till specialister. Farliga höjder tvingar fram ett omedelbart strömavbrott och evakuering av personal. Nu används även speciella installationer som kan lokalisera detonation av koldamm i de tidigaste skedena. Innan arbetspasset börjar reduceras mängden metan i gruvan till extremt säkra nivåer.
Det visar sig att faran med metan för människor kommer från två sidor samtidigt. Tendensen att detonera, den giftiga effekten, frånvaron av lukt och färg - allt detta gör den "explosiva gasen" otroligt farlig. För att inte möta sina värsta sidor är det värt att i förväg beställa en miljöbedömning som kan fastställa nivån på metankoncentrationen i luften.
Metan (CH4) är en inert gas och tillhör gruppen mättade kolväten. Denna gas är det huvudsakliga utvunna elementet av gaser från gruvor, träsk, naturliga och tillhörande oljefält. Dessutom, i processen med sönderfall av organiskt material under påverkan av högt tryck, en viss temperatur och påverkan av mikrober, sker allt detta utan tillgång till oxidationsmedel som syre, till exempel frigörs metangas i naturen. De största gasfyndigheterna finns på platser där det fanns skog för miljoner år sedan, och nu våtmarker. Metan är svårlösligt i H2O (vatten) och andra kemiska vätskor. Metan omvandlas till flytande tillstånd endast vid en kritisk temperatur, vid ca -160C, så metan transporteras i form av en gas, men gasen står under ett mycket högt tryck på ca 200 atm. Det sorberas dock av hårda adsorbenter, såsom aktivt kol och kolväten. Han visade sig ha den kortaste kapaciteten att absorberas, som ett resultat av detta används denna egenskap hos honom säkert vid rengöring av CH4-gas från andra föroreningar.
Propan (C3H8) är en gas som erhålls från oljeproduktion och olika oljeindustrier, som kan lagras och transporteras i flytande form vid ett ganska lågt tryck på 5 atmosfärer och vid standard gatu- eller rumstemperatur. Används oftast för lagring och transport. Propan, en gas som inte äger färg och arom, är lätt giftig men har en liten effekt av drogförgiftning och är extremt explosiv och brandfarlig, mycket tyngre än luft.
Vad är skillnaden mellan propangaser och metangaser?:
Jämförelse av metan och propan:
Vad är skillnaden mellan metan och propan? Den viktigaste skillnaden mellan dessa gaser i praktiken är att metan har 2,5 gånger lägre förbränningsvärme än propan. Som ett resultat är propan som bränsle mycket effektivare, oftast används propan för svetsning, uppvärmning av hem och som bränsle i fordon.
C3H8 är tyngre än luft, vilket man inte kan säga om CH4. Vid dålig rörisolering uppstår ett läckage i systemet, metan löses upp och hänger i luften. Varje minsta andetag av luft hjälper den att röra sig över långa avstånd. Metan är extremt explosivt, mer än 2 gånger farligare än propan. Som ett resultat är det mer osäkert för människor än propan. Det är av denna anledning som säkerhetsåtgärder och kvaliteten på stumfogar alltid kontrolleras i hus och lokaler där gasledningar passerar.
Propan kännetecknas av en svag narkotisk effekt på kroppen. Metan har den kortaste kemiska energin. Metan är svårt att kondensera, vilket är ett plus, eftersom det inte är nödvändigt att dränera kondensatet och avfallshartser i processen att arbeta med det. För att göra metan flytande krävs en temperatur på -160C grader, och propan görs helt enkelt flytande med kallt vatten vid lämpligt tryck. Jämfört med propan har metan den kortaste obskurantistiska kapaciteten.
Skillnaden mellan metan och propan:
1. Propan som bränsle är effektivare än metan eftersom det avger mer värme vid förbränning. Propan är mer lämpligt för svetsning och tillverkning.
2. Metan är mer inert. Propan är mer aktivt i olika kemiska reaktioner.
3.Propan har en narkotisk effekt, och metan är mer explosivt
4. Olika tryck under transport för propan krävs vanliga stålcylindrar med en väggtjocklek på endast 4-5 mm och för metan många gånger tjockare, varför cylindrar gjorda av kombinerade material används för att transportera metan för att minska vikten av cylindern.
5. bekvämare och i vissa fall billigare, särskilt om du tar hänsyn till kostnaden för metancylindrar. Och generellt sett är ingen endast engagerad i utbyte av metancylindrartack vare enkel förvaring och transport.
I sällskap du kan alltid fylla, byta och flaskor för olika typer av gas. Våra chefer hjälper alltid till med att organisera leveransen till din anläggning.
Farliga föroreningar i gruvluften
Giftiga föroreningar i gruvluften inkluderar kolmonoxid, kväveoxider, svaveldioxid och vätesulfid.
Kolmonoxid (CO) - färglös, smaklös och luktfri gas med en specifik vikt på 0,97. Bränns och exploderar i en koncentration av 12,5 till 75 %. Tändtemperatur, vid en koncentration av 30 %, 630-810 0 C. Mycket giftig. Dödlig koncentration - 0,4%. Tillåten koncentration i gruvdrift - 0,0017%. Den främsta hjälpen vid förgiftning är konstgjord andning i arbetet med frisk luft.
Källor till kolmonoxid är sprängning, förbränningsmotorer, gruvbränder och metan- och koldammexplosioner.
Kväveoxider (NO) De är bruna till färgen och har en karakteristisk stickande lukt. Mycket giftig, orsaka irritation av slemhinnorna i luftvägarna och ögonen, lungödem. Dödlig koncentration, med kortvarig inandning, är 0,025 %. Det begränsande innehållet av kväveoxider i gruvluften bör inte överstiga 0,00025 % (i termer av dioxid - NO 2). För kvävedioxid - 0,0001%.
Svaveldioxid (SO 2)- färglös, med stark irriterande lukt och syrlig smak. Tyngre än luft 2,3 gånger. Mycket giftigt: irriterar slemhinnorna i luftvägarna och ögonen, orsakar inflammation i luftrören, svullnad av struphuvudet och luftrören.
Svaveldioxid bildas vid sprängning (i svavelhaltiga bergarter), bränder och frigörs från stenar.
Det begränsande innehållet i gruvluften är 0,00038 %. En koncentration på 0,05 % är livshotande.
Svavelväte (H 2 S)- gas utan färg, med en sötaktig smak och doften av ruttna ägg. Den specifika vikten är 1,19. Svavelväte brinner och vid en koncentration på 6 % exploderar det. Mycket giftig, irriterar slemhinnorna i luftvägarna och ögonen. Dödlig koncentration - 0,1%. Första hjälpen vid förgiftning - konstgjord andning på en frisk ström, inandning av klor (med en näsduk fuktad med blekmedel).
Svavelväte frigörs från stenar och mineralkällor. Det bildas under sönderfall av organiskt material, gruvbränder och sprängning.
Svavelväte är mycket lösligt i vatten. Detta måste beaktas vid förflyttning av människor längs övergivna arbetsplatser.
Den tillåtna halten H 2 S i gruvluften bör inte överstiga 0,00071 %.
Föreläsning 2
Metan och dess egenskaper
Metan är den huvudsakliga, vanligaste delen av eldgas. I litteraturen och i praktiken identifieras metan oftast med brandgas. I gruvventilation får denna gas mest uppmärksamhet på grund av dess explosiva egenskaper.
Fysikaliska och kemiska egenskaper hos metan.
Metan (CH 4)är en färglös, smaklös och luktfri gas. Densitet - 0,0057. Metan är inert, men genom att tränga undan syre (förskjutning sker i följande proportion: 5 volymenheter metan ersätter 1 volymenhet syre, d.v.s. 5:1) kan det vara farligt för människor. Den antänds vid en temperatur av 650-750 0 C. Metan bildar brännbara och explosiva blandningar med luft. När innehållet i luften är upp till 5-6% brinner det vid en värmekälla, från 5-6% till 14-16% - exploderar, mer än 14-16% - exploderar inte. Explosionens största kraft vid en koncentration av 9,5 %.
En av egenskaperna hos metan är blixtfördröjningen efter kontakt med en antändningskälla. Blixtfördröjningstiden anropas induktion period. Närvaron av denna period skapar förutsättningar för att förhindra utbrott under sprängning med hjälp av säkerhetssprängämnen (BB).
Gastrycket vid explosionsplatsen är cirka 9 gånger högre än det initiala trycket för gas-luftblandningen före explosionen. I detta fall, tryck upp till 30 på och högre. Olika hinder i driften (förträngningar, utsprång etc.) bidrar till ett ökat tryck och ökar hastigheten för sprängvågens utbredning i gruvdriften.