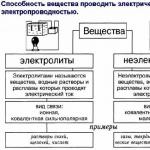
Elektrolyter är ämnen vars smältor eller lösningar leder elektricitet. Elektrolyter inkluderar syror, baser och de flesta salter.
Dissociation av elektrolyter
Elektrolyter är ämnen med joniska eller högpolära kovalenta bindningar. De förra existerar i form av joner redan innan de överförs till ett löst eller smält tillstånd. Elektrolyter inkluderar salter, baser, syror.

Ris. 1. Tabellskillnad mellan elektrolyter och icke-elektrolyter.
Skilj mellan starka och svaga elektrolyter. Starka elektrolyter, när de löses i vatten, dissocierar fullständigt till joner. Dessa inkluderar: nästan alla lösliga salter, många oorganiska syror (till exempel H 2 SO 4 , HNO 3 , HCl), hydroxider av alkali- och jordalkalimetaller. Svaga elektrolyter, när de löses i vatten, dissocierar något till joner. Dessa inkluderar nästan alla organiska syror, vissa oorganiska syror (till exempel H 2 CO 3), många hydroxider (förutom hydroxider av alkali och alkaliska jordartsmetaller).

Ris. 2. Tabell över starka och svaga elektrolyter.
Vatten är också en svag elektrolyt.
Liksom andra kemiska reaktioner skrivs elektrolytisk dissociation i lösningar som dissociationsekvationer. Samtidigt, för starka elektrolyter, anses processen gå irreversibelt, och för elektrolyter av medelstyrka och svaga, som en reversibel process.
syror- Dessa är elektrolyter, vars dissociation i vattenlösningar fortskrider med bildning av vätejoner som katjoner. Flerbasiska syror dissocierar i steg. Varje nästa steg går med mer och mer svårighet, eftersom de resulterande jonerna av syrarester är svagare elektrolyter.
Grunder- elektrolyter som dissocierar i en vattenlösning med bildning av en hydroxidjon OH- som en anjon. Bildandet av hydroxidjoner är ett vanligt drag för baser och bestämmer de allmänna egenskaperna hos starka baser: alkalisk karaktär, bitter smak, tvålighet vid beröring, reaktion på en indikator, neutralisering av syror, etc.
Alkalier, även svagt lösliga sådana (till exempel bariumhydroxid Ba (OH) 2) dissocierar fullständigt, till exempel:
Ba (OH) 2 \u003d Ba 2 + 2OH-
salt-- dessa är elektrolyter som dissocierar i en vattenlösning med bildning av en metallkatjon och en syrarest. Salter dissocierar inte i steg, utan helt:
Ca (NO 3) 2 \u003d Ca 2 + + 2NO 3 -
Teori om elektrolytisk dissociation
elektrolyter- ämnen som genomgår elektrolytisk dissociation i lösningar eller smälter och leder elektrisk ström på grund av jonernas rörelse.
Elektrolytisk dissociation är nedbrytningen av elektrolyter till joner när de löses i vatten.
Teorin om elektrolytisk dissociation (S. Arrhenius, 1887) i modern mening inkluderar följande bestämmelser:
- Elektrolyter, när de löses i vatten, sönderdelas (dissocieras) till joner - positiva (katjoner) och negativa (anjoner). Jonisering sker lättast för föreningar med en jonbindning (salter, alkalier), som, när de löses upp (en endoterm process för förstörelse av kristallgittret), bildar hydratiserade joner.

Ris. 3. Schema för elektrolytisk dissociation av salt.
Hydrering av joner är en exoterm process. Förhållandet mellan energikostnader och vinster avgör möjligheten till jonisering i lösning. När ett ämne med en polär kovalent bindning (till exempel väteklorid HCl) löses, orienterar vattendipolerna sig vid motsvarande poler av den lösta molekylen, polariserar bindningen och omvandlar den till en jonisk, följt av hydrering av jonerna. Denna process är reversibel och kan gå antingen helt eller delvis.
- hydratiserade joner är stabila och rör sig slumpmässigt i lösning. Under inverkan av en elektrisk ström får rörelsen en riktad karaktär: katjoner rör sig mot det negativa bältet (katoden) och anjoner - mot det positiva bältet (anoden).
- dissociation (jonisering) är en reversibel process. Fullständigheten av jonisering beror på elektrolytens natur (alkalisalter dissocierar nästan helt), dess koncentration (jonisering blir svårare med en ökning av koncentrationen), temperatur (en ökning av temperaturen främjar dissociation), lösningsmedlets natur (jonisering). förekommer endast i ett polärt lösningsmedel, i synnerhet i vatten).
- (Grekisk). En flytande kropp som bryts ned av en elektrisk (galvanisk) ström. Ordbok med främmande ord som ingår i det ryska språket. Chudinov A.N., 1910. ELEKTROLYT En vätska som utsätts för nedbrytning av galvanisk ström. ... ... Ordbok med främmande ord på ryska språket
elektrolyt- a, m. elektrolyt m. elektro + gr. lytos är nedbrytbart. specialist. Ett kemiskt ämne (i smälta eller lösning) som kan sönderdelas till sina beståndsdelar när en elektrisk ström passerar genom den. batterielektrolyt. BAS 1. Kasta ... ... Historisk ordbok över gallicismer i det ryska språket
elektrolyt- En lösning där, när en elektrisk ström passerar genom den, sker nedbrytning av ett ämne, vilket leder till uppkomsten av en elektrisk ström. Elektrolyten är grunden för ackumulatorer och batterier. [Hypertextuppslagsverkslexikon om ... ... Teknisk översättarhandbok
ELEKTROLYT- ELEKTROLYT, en lösning eller smält salt som kan leda elektricitet och som används för ELEKTROLYS (under vilken det sönderdelas). Ström i elektrolyter leds av laddade partiklar IONS, inte elektroner. Till exempel i bly ... ... Vetenskaplig och teknisk encyklopedisk ordbok
ELEKTROLYT- ELEKTROLYT, elektrolyt, make. (från ordet elektrisk och grekiska lytos upplöst) (fysisk). En lösning av ett ämne som kan brytas ned till dess beståndsdelar genom elektrolys. Ushakovs förklarande ordbok. D.N. Ushakov. 1935 1940 ... Ushakovs förklarande ordbok
elektrolyt- substantiv, antal synonymer: 1 katolyt (1) ASIS Synonym Dictionary. V.N. Trishin. 2013 ... Synonym ordbok
Elektrolyt- Elektrolyter är ämnen, lösningar och legeringar av vilka tillsammans med andra ämnen elektrolytiskt leder galvanisk ström. Ett tecken på elektrolytisk ledningsförmåga, i motsats till metallisk, bör betraktas som förmågan att observera kemikalier ... ... Encyclopedia of Brockhaus and Efron
elektrolyt- - ett ämne vars vattenlösning eller smälta leder en elektrisk ström. Allmän kemi: lärobok / A. V. Zholnin ... Kemiska termer
ELEKTROLYT- ett ämne vars vattenlösning eller smälta leder en elektrisk ström (se), som härrör från elektrolytisk (se). Detta E., även kallat (se) det andra slaget, skiljer sig från metaller (ledare av det första slaget), där överföringen ... Great Polytechnic Encyclopedia
Böcker
- , Gorichev Igor Georgievich , Atanasyan T. K. , Yakusheva E. A. Kategori: Övrigt Förlag: Prometheus, Tillverkare: Prometheus, Köp för 483 UAH (endast Ukraina)
- Oorganisk kemi. Del I. Ytfenomen vid gränssnittet oxid/elektrolyt i sura medier, Gorichev Igor Georgievich, Atanasyan T. K., Yakusheva E. A. elektriskt dubbelskikt på... Kategori: Kemivetenskap Förlag: Prometheus, Köp för 377 rubel
- Oorganisk kemi Del I Ytfenomen vid oxid-elektrolytgränsen i sura media Handledning ,
I avsnittet om frågan Vilka ämnen är elektrolyter? ges av författaren Olga Dubrovina det bästa svaret är Ämnen som sönderfaller till joner i lösningar eller smälter och därför leder elektrisk ström kallas elektrolyter. Ämnen som inte sönderfaller till joner under samma förhållanden och inte leder elektrisk ström kallas icke-elektrolyter. Starka elektrolyter är ämnen som, när de löses upp i vatten, nästan helt sönderfaller till joner. Som regel inkluderar starka elektrolyter ämnen med joniska eller högpolära bindningar: alla mycket lösliga salter, starka syror (HCl, HBr, HI, HClO4, H2SO4, HNO3) och starka baser (LiOH, NaOH, KOH, RbOH, CsOH, Ba (OH) 2, Sr (OH) 2, Ca (OH) 2. I en stark elektrolytlösning finns det lösta ämnet huvudsakligen i form av joner (katjoner och anjoner); icke-dissocierade molekyler är praktiskt taget frånvarande Svaga elektrolyter Ämnen som delvis dissocierar till joner. Lösningar av svaga elektrolyter, tillsammans med joner, innehåller odissocierade molekyler. Svaga elektrolyter kan inte ge en hög koncentration av joner i lösning. Svaga elektrolyter inkluderar: 1) nästan alla organiska syror (CH3COOH, C2H5COOH, etc.); 2) vissa oorganiska syror (H2CO3, H2S, etc.); 3) nästan alla dåliga lösliga salter, baser och ammoniumhydroxid i vatten (Ca3 (PO4) 2; Cu (OH) 2; Al (OH) 3; NH4OH); 4) vatten. De leder dåligt (eller nästan inte) elektrisk ström. СH3COOH « CH3COO - + H+Cu(OH)2 « + + OH- (första steget)+ « Cu2+ + OH- (andra steget) H2CO3 « H+ + HCO- (första steget) HCO3- « H+ + CO32- (andra steget)
Svar från Prosyanka[guru]
syror, baser och vissa salter
Svar från Europeiska[guru]
Ja, syror, salter och alkalier, men i allmänhet de som i löst tillstånd inte uppför det i sin rena form
Svar från Anpassningsförmåga[guru]
Alla som dissocierar till joner i vatten .. :-))
Svar från Anel Saduakasova[nybörjare]
ELEKTROLYTER är lösningar av salter, syror och alkalier, samt smälta salter och metaller. Elektrolyter är bra ledare av elektrisk ström.
Svar från Olia Titova[nybörjare]
alla mycket lösliga salter, starka syror (HCl, HBr, HI, HClO4, H2SO4, HNO3) och starka baser (LiOH, NaOH, KOH, RbOH, CsOH, Ba(OH)2,Sr(OH)2,Ca(OH) 2).
Svar från Yohlana[bemästra]
Elektrolyter inkluderar: syror, salter, alkalier
Svar från Ling Kwon[nybörjare]
Med jonisk och kovalent polär typ av kemisk bindning.
Elektrolyter som kemikalier har varit kända sedan urminnes tider. De har dock erövrat de flesta av sina användningsområden relativt nyligen. Vi kommer att diskutera de mest prioriterade områdena för industrin att använda dessa ämnen och ta reda på vad de senare är och hur de skiljer sig från varandra. Men låt oss börja med en utflykt till historien.
Berättelse
De äldsta kända elektrolyterna är salter och syror, upptäckta i den antika världen. Men idéer om strukturen och egenskaperna hos elektrolyter har utvecklats över tiden. Teorier om dessa processer har utvecklats sedan 1880-talet, då ett antal upptäckter gjordes relaterade till teorier om egenskaperna hos elektrolyter. Det har skett flera kvalitativa språng i teorier som beskriver mekanismerna för interaktionen mellan elektrolyter och vatten (trots allt, bara i lösning får de egenskaperna på grund av vilka de används i industrin).
Nu ska vi i detalj analysera flera teorier som har haft störst inflytande på utvecklingen av idéer om elektrolyter och deras egenskaper. Och låt oss börja med den vanligaste och enklaste teorin som var och en av oss klarade i skolan.
Arrhenius teori om elektrolytisk dissociation
1887 skapade den svenske kemisten och Wilhelm Ostwald teorin om elektrolytisk dissociation. Allt är dock inte så enkelt här heller. Arrhenius själv var en anhängare av den så kallade fysikaliska teorin om lösningar, som inte tog hänsyn till de ingående ämnenas interaktion med vatten och hävdade att det finns fria laddade partiklar (joner) i lösningen. Det är förresten från sådana positioner som elektrolytisk dissociation övervägs i skolan idag.
Låt oss prata om vad denna teori ger och hur den förklarar för oss mekanismen för interaktion mellan ämnen och vatten. Precis som alla andra har hon flera postulat som hon använder:
1. Vid interaktion med vatten sönderdelas ämnet till joner (positiv - katjon och negativ - anjon). Dessa partiklar genomgår hydratisering: de drar till sig vattenmolekyler, som förresten är positivt laddade på ena sidan och negativt laddade på den andra (bildar en dipol), som ett resultat, de bildas till vattenkomplex (solvat).
2. Dissociationsprocessen är reversibel - det vill säga om ämnet har brutit upp till joner, kan det under påverkan av alla faktorer igen förvandlas till den ursprungliga.
3. Om du ansluter elektroder till lösningen och sätter på strömmen kommer katjonerna att börja röra sig mot den negativa elektroden - katoden, och anjonerna mot den positivt laddade - anoden. Det är därför ämnen som är mycket lösliga i vatten leder elektriciteten bättre än vattnet självt. Av samma anledning kallas de elektrolyter.
4. elektrolyt kännetecknar procentandelen av ett ämne som har genomgått upplösning. Denna indikator beror på egenskaperna hos lösningsmedlet och själva lösta ämnet, på koncentrationen av det senare och på den yttre temperaturen.
Här är faktiskt alla huvudpostulaten för denna enkla teori. Vi kommer att använda dem i den här artikeln för att beskriva vad som händer i en elektrolytlösning. Vi kommer att analysera exempel på dessa föreningar lite senare, men nu kommer vi att överväga en annan teori.

Lewis syra- och basteori
Enligt teorin om elektrolytisk dissociation är en syra ett ämne i vilket en vätekatjon finns, och en bas är en förening som sönderdelas till en hydroxidanjon i lösning. Det finns en annan teori uppkallad efter den berömda kemisten Gilbert Lewis. Det låter dig utvidga begreppet syra och bas något. Enligt Lewis teori är syror molekyler av ett ämne som har fria elektronorbitaler och kan acceptera en elektron från en annan molekyl. Det är lätt att gissa att baserna kommer att vara sådana partiklar som kan donera en eller flera av sina elektroner till "användningen" av syran. Det är mycket intressant här att inte bara en elektrolyt, utan också vilken substans som helst, även olöslig i vatten, kan vara en syra eller bas.

Protolitisk Brendsted-Lowry-teori
År 1923, oberoende av varandra, föreslog två forskare - J. Bronsted och T. Lowry - en teori som nu aktivt används av forskare för att beskriva kemiska processer. Kärnan i denna teori är att meningen med dissociation reduceras till överföringen av en proton från en syra till en bas. Sålunda förstås den senare här som en protonacceptor. Då är syran deras givare. Teorin förklarar också väl förekomsten av ämnen som uppvisar egenskaperna hos både syror och baser. Sådana föreningar kallas amfotera. I Bronsted-Lowry-teorin används även termen amfolyter för dem, medan syror eller baser brukar kallas protoliter.
Vi har kommit till nästa del av artikeln. Här kommer vi att berätta hur starka och svaga elektrolyter skiljer sig från varandra och diskutera påverkan av externa faktorer på deras egenskaper. Och sedan går vi vidare till beskrivningen av deras praktiska tillämpning.
Starka och svaga elektrolyter
Varje ämne interagerar med vatten individuellt. Vissa löser sig bra i det (till exempel bordssalt), medan vissa inte löser sig alls (till exempel krita). Alltså delas alla ämnen in i starka och svaga elektrolyter. De senare är ämnen som interagerar dåligt med vatten och lägger sig i botten av lösningen. Detta innebär att de har en mycket låg grad av dissociation och en hög bindningsenergi, vilket under normala förhållanden inte tillåter molekylen att sönderdelas till sina beståndsdelar joner. Dissociationen av svaga elektrolyter sker antingen mycket långsamt eller med en ökning av temperatur och koncentration av detta ämne i lösning.
Låt oss prata om starka elektrolyter. Dessa inkluderar alla lösliga salter, såväl som starka syror och alkalier. De bryts lätt upp till joner och det är mycket svårt att samla dem i nederbörd. Strömmen i elektrolyter, förresten, utförs exakt tack vare jonerna som finns i lösningen. Därför leder starka elektrolyter ström bäst av allt. Exempel på det senare: starka syror, alkalier, lösliga salter.

Faktorer som påverkar beteendet hos elektrolyter
Låt oss nu ta reda på hur en förändring i den yttre miljön påverkar koncentrationen direkt påverkar graden av elektrolytdissociation. Dessutom kan detta förhållande uttryckas matematiskt. Lagen som beskriver detta samband kallas Ostwalds utspädningslag och är skriven på följande sätt: a = (K / c) 1/2. Här är a graden av dissociation (tagen i bråkdelar), K är dissociationskonstanten, som är olika för varje ämne, och c är koncentrationen av elektrolyten i lösningen. Med denna formel kan du lära dig mycket om ämnet och dess beteende i lösning.
Men vi avviker från ämnet. Utöver koncentrationen påverkas även graden av dissociation av elektrolytens temperatur. För de flesta ämnen ökar lösligheten och reaktiviteten genom att öka den. Detta kan förklara förekomsten av vissa reaktioner endast vid förhöjda temperaturer. Under normala förhållanden går de antingen mycket långsamt eller i båda riktningarna (en sådan process kallas reversibel).
Vi har analyserat de faktorer som bestämmer beteendet hos ett system som en elektrolytlösning. Låt oss nu gå vidare till den praktiska tillämpningen av dessa, utan tvekan, mycket viktiga kemikalier.

Industriell användning
Alla har förstås hört ordet "elektrolyt" i förhållande till batterier. Bilen använder blybatterier, elektrolyten i vilken är 40% svavelsyra. För att förstå varför detta ämne överhuvudtaget behövs där, är det värt att förstå funktionerna i driften av batterier.
Så vad är principen för drift av alla batterier? I dem sker en reversibel reaktion av omvandlingen av ett ämne till ett annat, som ett resultat av vilket elektroner frigörs. När batteriet laddas sker en växelverkan av ämnen, som inte erhålls under normala förhållanden. Detta kan representeras som ackumulering av elektricitet i ett ämne som ett resultat av en kemisk reaktion. När urladdningen börjar, börjar den omvända transformationen, vilket leder systemet till det initiala tillståndet. Dessa två processer utgör tillsammans en laddnings-urladdningscykel.
Tänk på ovanstående process på ett specifikt exempel - ett blybatteri. Som du kanske gissar består denna strömkälla av ett element som innehåller bly (liksom blydioxid PbO 2) och syra. Alla batterier består av elektroder och utrymmet mellan dem, bara fyllt med elektrolyt. Som den sista, som vi redan har tagit reda på, i vårt exempel används svavelsyra i en koncentration av 40 procent. Katoden i ett sådant batteri är gjord av blydioxid och anoden är gjord av rent bly. Allt detta beror på att olika reversibla reaktioner inträffar på dessa två elektroder med deltagande av joner i vilka syran har dissocierat:
- PbO 2 + SO 4 2- + 4H + + 2e - \u003d PbSO 4 + 2H 2 O (reaktion sker vid den negativa elektroden - katod).
- Pb + SO 4 2- - 2e - \u003d PbSO 4 (Reaktion sker vid den positiva elektroden - anod).
Om vi läser reaktionerna från vänster till höger - får vi de processer som sker när batteriet laddas ur, och om från höger till vänster - vid laddning. Var och en av dessa reaktioner är olika, men mekanismen för deras förekomst beskrivs generellt på samma sätt: två processer inträffar, i en av vilka elektroner "absorberas", och i den andra, tvärtom, "går de". Det viktigaste är att antalet absorberade elektroner är lika med antalet emitterade.
I själva verket, förutom batterier, finns det många användningsområden för dessa ämnen. I allmänhet är elektrolyter, exempel på vilka vi har gett, bara ett korn av de olika ämnen som kombineras under denna term. De omger oss överallt, överallt. Ta till exempel människokroppen. Tror du att dessa ämnen inte finns där? Du har väldigt fel. De finns överallt i oss, och den största mängden är blodelektrolyter. Dessa inkluderar till exempel järnjoner, som är en del av hemoglobinet och hjälper till att transportera syre till vävnaderna i vår kropp. Blodelektrolyter spelar också en nyckelroll i regleringen av vatten-saltbalans och hjärtfunktion. Denna funktion utförs av kalium- och natriumjoner (det finns till och med en process som sker i celler, som kallas kalium-natriumpumpen).
Alla ämnen som du kan lösa upp åtminstone lite är elektrolyter. Och det finns ingen sådan industri och vårt liv med dig, var de än tillämpas. Detta är inte bara batterier i bilar och batterier. Detta är någon kemisk och livsmedelsproduktion, militära anläggningar, klädfabriker och så vidare.
Elektrolytens sammansättning är förresten annorlunda. Så det är möjligt att skilja sur och alkalisk elektrolyt. De skiljer sig i grunden i sina egenskaper: som vi redan har sagt är syror protondonatorer och alkalier är acceptorer. Men med tiden förändras elektrolytens sammansättning på grund av förlusten av en del av ämnet, koncentrationen antingen minskar eller ökar (allt beror på vad som går förlorat, vatten eller elektrolyt).
Vi möter dem varje dag, men få människor vet exakt definitionen av en sådan term som elektrolyter. Vi har analyserat exempel på specifika ämnen, så låt oss gå vidare till lite mer komplexa begrepp.

Fysikaliska egenskaper hos elektrolyter
Nu om fysik. Det viktigaste att förstå när man studerar detta ämne är hur ström överförs i elektrolyter. Joner spelar en avgörande roll i detta. Dessa laddade partiklar kan överföra laddning från en del av lösningen till en annan. Så anjoner tenderar alltid till den positiva elektroden och katjoner - till den negativa. På så sätt agerar vi på lösningen med en elektrisk ström, separerar vi laddningarna på olika sidor av systemet.
En sådan fysisk egenskap som densitet är mycket intressant. Många egenskaper hos föreningarna vi diskuterar beror på det. Och frågan dyker ofta upp: "Hur höjer man elektrolytens densitet?" Faktum är att svaret är enkelt: du måste sänka vattenhalten i lösningen. Eftersom elektrolytens densitet till största delen bestäms, beror den mest på koncentrationen av den senare. Det finns två sätt att genomföra planen. Den första är ganska enkel: koka elektrolyten som finns i batteriet. För att göra detta måste du ladda den så att temperaturen inuti stiger något över hundra grader Celsius. Om den här metoden inte hjälper, oroa dig inte, det finns en annan: byt bara ut den gamla elektrolyten med en ny. För att göra detta, töm den gamla lösningen, rengör insidan av svavelsyrarester med destillerat vatten och häll sedan i en ny portion. Som regel har högkvalitativa elektrolytlösningar omedelbart den önskade koncentrationen. Efter byte kan du glömma länge hur man höjer elektrolytens densitet.
Elektrolytens sammansättning bestämmer till stor del dess egenskaper. Egenskaper såsom elektrisk ledningsförmåga och densitet är till exempel starkt beroende av det lösta ämnets natur och dess koncentration. Det finns en separat fråga om hur mycket elektrolyt som kan finnas i batteriet. Faktum är att dess volym är direkt relaterad till produktens deklarerade effekt. Ju mer svavelsyra inne i batteriet, desto kraftfullare är det, det vill säga desto mer spänning kan det leverera.

Var är det användbart?
Om du är en bilentusiast eller bara förtjust i bilar, då förstår du själv allt. Säkert vet du till och med hur man avgör hur mycket elektrolyt som finns i batteriet nu. Och om du är långt ifrån bilar, kommer det inte att vara överflödigt att känna till egenskaperna hos dessa ämnen, deras tillämpningar och hur de interagerar med varandra. Medveten om detta kommer du inte att gå vilse om du blir ombedd att säga vilken elektrolyt som finns i batteriet. Även om du inte är en bilentusiast, men du har en bil, kommer det inte att vara överflödigt att känna till batterienheten och hjälpa dig med reparationer. Det blir mycket lättare och billigare att göra allt själv än att gå till bilcentret.
Och för att bättre studera detta ämne rekommenderar vi att du läser en lärobok i kemi för skolor och universitet. Om du kan denna vetenskap väl och har läst tillräckligt med läroböcker, skulle Varypaevs "Kemiska strömkällor" vara det bästa alternativet. Den beskriver i detalj hela teorin om hur batterier, olika batterier och väteceller fungerar.
Slutsats
Vi har kommit till slutet. Låt oss sammanfatta. Ovan har vi analyserat allt relaterat till ett sådant koncept som elektrolyter: exempel, teori om struktur och egenskaper, funktioner och tillämpningar. Återigen är det värt att säga att dessa föreningar är en del av vårt liv, utan vilka våra kroppar och alla industriområden inte skulle kunna existera. Kommer du ihåg blodelektrolyter? Tack vare dem lever vi. Hur är det med våra bilar? Med denna kunskap kommer vi att kunna åtgärda alla problem som är relaterade till batteriet, eftersom vi nu förstår hur man ökar tätheten av elektrolyten i det.
Det är omöjligt att berätta allt, och vi satte inte upp ett sådant mål. Det är trots allt inte allt som kan sägas om dessa fantastiska ämnen.
En kort version av materialet på ämnet "Elektrolyter och icke-elektrolyter". Gör att du snabbt kan orientera dig i ämnet, tk. presenteras i form av en tabell med definitioner och exempel. Det kommer att hjälpa till att systematisera kunskap, förbereda för verifiering och testarbete.
Visa dokumentinnehåll
"Spjälsäng "elektrolyter och icke-elektrolyter""
ÄMNEN
| elektrolyter | icke-elektrolyter |
| ledare av det andra slaget | (eftersom de inte bildar joner) |
| ämnen med
syror(HCl, HNO3, CH3COOH) , grunder(KOH, NaOH, Ba (OH) 2), salt-(KCl, NH4NO3, MgSO4), vatten | ämnen med
organiska föreningar enkla ämnen icke-metaller(N 2, O 2, H 2) |
ELEKTROLYTER
| stark | svag |
| grad av dissociation är mindre än 3 % |
|
| alla salter starka syror starka baser(LiOH, KOH, NaOH, Ba(OH) 2)) | svagsyror svaga baser |
| vid utspädning kan bli stark. |
|
Grad av dissociation (α)
α = N spridning. /N totalt
_____________________________________________________________________________________
Enligt förmågan att leda ström i en vattenlösning eller smälta
ÄMNEN
| elektrolyter | icke-elektrolyter |
| leda ström i lösning eller smälta (eftersom det finns laddade partiklar - joner), ledare av det andra slaget | led inte ström i lösning eller smält (eftersom de inte bildar joner) |
| ämnen med jonisk eller högpolär kovalent bindning syror(HCl, HNO3, CH3COOH) , grunder(KOH, NaOH, Ba (OH) 2), salt-(KCl, NH4NO3, MgSO4), vatten | ämnen med icke-polär eller svagt polär kovalent bindning organiska föreningar(kolväten, sackaros, alkoholer), enkla ämnen icke-metaller(N 2, O 2, H 2) |
ELEKTROLYTER
| stark | svag |
| graden av dissociation är mer än 30 % | grad av dissociation är mindre än 3 % |
| alla salter– både lösliga och svårlösliga; starka syror(HCl, HBr, HI, HNO3, HCI03, HCI04, H2SO4 (utspädd)); starka baser(LiOH, KOH, NaOH, Ba(OH) 2)) | svagsyror(H2S, H2S03, H2CO3, H2SiO3, CH3COOH); svaga baser- olösliga metallhydroxider och NH4OH. |
| Graden av dissociation beror på koncentrationen av ämnet i lösningen, så några svaga elektrolyter vid utspädning kan bli stark. |
|
Grad av dissociation (α)är förhållandet mellan antalet molekyler som sönderdelas till joner (N-sönderfall) och det totala antalet lösta molekyler (N totalt)
α = N spridning. /N totalt