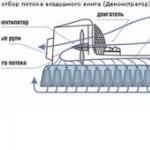
Nárast motorizácie so sebou prináša potrebu bezpečnostných opatrení životné prostredie. Ovzdušie v mestách je čoraz viac znečistené zdraviu škodlivými látkami, najmä oxidom uhoľnatým, nespálenými uhľovodíkmi, oxidmi dusíka, olovom, zlúčeninami síry atď. Vo veľkej miere ide o produkty nedokonalého spaľovania palív používaných v podnikoch, v každodennom života, ako aj v motoroch áut.
Spolu s toxickými látkami pri prevádzke vozidiel škodlivý účinok ich hluk ovplyvňuje aj obyvateľstvo. pozadu nedávne časy v mestách sa hlučnosť zvyšovala ročne o 1 dB, preto je potrebné zvyšovanie celkovej hlučnosti nielen zastaviť, ale aj dosiahnuť jej zníženie. Neustále vystavenie hluku spôsobuje nervové ochorenia, znižuje schopnosť ľudí pracovať, najmä tých, ktorí sa zaoberajú duševnou činnosťou. Motorizácia prináša hluk do predtým tichých vzdialených miest. Znižovaniu hluku, ktorý vytvárajú drevoobrábacie a poľnohospodárske stroje, sa, žiaľ, stále nevenuje náležitá pozornosť. Motorová píla vytvára vo veľkej časti lesa hluk, ktorý spôsobuje zmeny v životných podmienkach zvierat a často spôsobuje vyhynutie niektorých druhov.
Kritiku však najčastejšie vyvoláva znečistenie ovzdušia výfukovými plynmi vozidiel.
Pri hustej premávke sa výfukové plyny hromadia v blízkosti povrchu pôdy a za prítomnosti slnečného žiarenia najmä v priemyselných mestách nachádzajúcich sa v zle vetraných dutinách vzniká takzvaný smog. Atmosféra je znečistená do takej miery, že pobyt v nej je zdraviu škodlivý. Dopravní dôstojníci umiestnení na niektorých rušných križovatkách nosia kyslíkové masky, aby chránili svoje zdravie. Škodlivý je najmä pomerne ťažký oxid uhoľnatý nachádzajúci sa v blízkosti zemského povrchu, prenikajúci do nižších poschodí budov, garáží a neraz vedie k úmrtiam.
Legislatívne podniky obmedzujú obsah škodlivých látok vo výfukových plynoch áut a neustále sa sprísňujú (tabuľka 1).
Predpisy sú pre výrobcov automobilov veľkým problémom; nepriamo ovplyvňujú aj efektivitu cestnej dopravy.
Na úplné spálenie paliva je možné povoliť prebytočný vzduch, aby sa zabezpečilo dobré vytlačenie paliva. Potrebný prebytok vzduchu závisí od stupňa zmiešania paliva so vzduchom. V karburátorových motoroch tento proces trvá značné množstvo času, pretože cesta paliva od zariadenia na tvorbu zmesi k zapaľovacej sviečke je pomerne dlhá.
Moderný karburátor umožňuje tvarovanie rôzne druhy zmesi. Na studený štart motora je potrebná najbohatšia zmes, pretože značná časť paliva kondenzuje na stenách sacieho potrubia a nevstupuje okamžite do valca. V tomto prípade sa odparí len malá časť ľahkých frakcií paliva. Keď sa motor zahreje, je potrebná aj bohatá zmes.
Keď je auto v pohybe, zloženie zmesi vzduch-palivo by malo byť zlé, čo zabezpečí dobrú účinnosť a nízku špecifickú spotrebu paliva. Za úspech maximálny výkon Motor musí mať bohatú zmes, aby sa naplno využila celá masa vzduchu vstupujúceho do valca. Aby sa zabezpečili dobré dynamické vlastnosti motora pri rýchlom otvorení škrtiacej klapky, je potrebné dodatočne dodať určité množstvo paliva do sacieho potrubia, čím sa kompenzuje palivo, ktoré sa v dôsledku toho usadilo a skondenzovalo na stenách potrubia. o zvýšení tlaku v ňom.
Pre dobré premiešanie paliva so vzduchom musí byť vytvorená vysoká rýchlosť vzduchu a rotácia. Ak je prierez difúzora karburátora konštantný, potom pri nízke frekvencie rotácia motora pre dobrú tvorbu zmesi, rýchlosť vzduchu v ňom je malá a pri vysokých rýchlostiach odpor difúzora vedie k zníženiu množstva vzduchu vstupujúceho do motora. Túto nevýhodu je možné odstrániť použitím karburátora s variabilnou sekciou difúzora alebo vstrekovaním paliva do sacieho potrubia.
V sacom potrubí je niekoľko typov systémov vstrekovania benzínu. V najčastejšie používaných systémoch je palivo dodávané cez samostatný vstrekovač pre každý valec, ktorý zabezpečuje rovnomernú distribúciu paliva medzi valcami, eliminuje usadzovanie a kondenzáciu paliva na studených stenách vstupného potrubia. Množstvo vstrekovaného paliva sa ľahšie priblíži k momentálne požadovanému optimu motora. Nie je potrebný difúzor, eliminujú sa energetické straty, ktoré vznikajú pri jeho prechode vzduchom. Príkladom takéhoto systému dodávky paliva je často používaný vstrekovací systém Bosch typu K-Jetronic používaný na.
Schéma tohto systému je znázornená na obr. 1. Kónická odbočná rúrka 1, v ktorej sa ventil 3 kýva na páke 2, je vyrobený tak, že zdvih ventilu je úmerný hmotnostnému prietoku vzduchu. Okná 5 na prechod paliva sa otvárajú cievkou 6 v telese regulátora, keď sa páka pohybuje pod vplyvom prúdu prichádzajúceho vzduchu. Potrebné zmeny v zložení zmesi v súlade s jednotlivými charakteristikami motora sú dosiahnuté tvarom kužeľovej dýzy. Páka s ventilom je vyvážená protizávažím, zotrvačné sily pri vibráciách vozidla ventil neovplyvňujú.
 |
| Ryža. 1. Systém vstrekovania benzínu Bosch K-Jetronic: |
|---|
| 1 - prívodné potrubie; 2 - páka ventilu vzduchového taniera; 3 - ventil vzduchovej dosky; 4 - škrtiaci ventil; 5 - okná; 6 - dávkovacia cievka; 7 - nastavovacia skrutka; 8 - vstrekovač paliva; 9 - spodná komora regulátora; 10 - rozvodný ventil; 11 - oceľová membrána; 12 - sedlo ventilu; 13 - pružina distribučného ventilu; 14 - redukčný ventil; 15 - palivové čerpadlo; 16 - palivová nádrž; 17 - palivový filter; 18 - regulátor tlaku paliva; 19 - prídavný regulátor prívodu vzduchu; 20 - obtokový ventil paliva; 21 - vstrekovač paliva so studeným štartom; 22 - termostatický snímač teploty vody. |
Prietok vzduchu vstupujúceho do motora je regulovaný škrtiacou klapkou 4. Tlmenie kmitov ventilov a tým aj cievky, ktoré vznikajú pri nízkych otáčkach motora v dôsledku pulzácií tlaku vzduchu v sacom potrubí, sa dosahuje tryskami v palivovom systéme. Na reguláciu množstva dodávaného paliva slúži aj skrutka 7 umiestnená v páke ventilu.
Medzi okienkom 5 a dýzou 8 je umiestnený rozdeľovací ventil 10, ktorý pomocou pružiny 13 a sedla 12 opierajúceho sa o membránu 11 udržuje konštantný vstrekovací tlak v rozprašovači dýzy 0,33 MPa pri tlaku pred ventilom 0,47. MPa.
Palivo z nádrže 16 je dodávané elektrickým palivovým čerpadlom 15 cez regulátor tlaku 18 a palivový filter 17 do spodnej komory 9 skrine regulátora. Konštantný tlak paliva v regulátore je udržiavaný redukčným ventilom 14 . Membránový regulátor 18 je určený na udržiavanie tlaku paliva, keď motor nebeží. To zabraňuje tvorbe vzduchových vreciek a zaisťuje dobrý štart horúceho motora. Regulátor tiež spomaľuje rast tlaku paliva pri štartovaní motora a tlmí jeho výkyvy v potrubí.
Studený štart motora uľahčuje niekoľko zariadení. Obtokový ventil 20 ovládaný bimetalovou pružinou otvára pri studenom štarte odtokové potrubie do palivovej nádrže, čím sa znižuje tlak paliva na konci cievky. Tým sa naruší rovnováha páky a rovnakému množstvu nasávaného vzduchu bude zodpovedať väčší objem vstrekovaného paliva. Ďalším zariadením je prídavný regulátor prívodu vzduchu 19, ktorého membrána je taktiež otváraná bimetalovou pružinou. Na prekonanie zvýšeného trecieho odporu studeného motora je potrebný ďalší vzduch. Tretím zariadením je vstrekovač 21 paliva pre studený štart ovládaný termostatom 22 vo vodnom plášti motora, ktorý udržuje vstrekovač otvorený, kým chladivo motora nedosiahne vopred stanovenú teplotu.
Elektronická výbava uvažovaného systému vstrekovania benzínu je obmedzená na minimum. Elektrické palivové čerpadlo sa pri zastavení motora vypne a prebytku vzduchu je menej ako pri priamom vstrekovaní paliva, avšak veľká chladiaca plocha stien vedie k veľkým tepelným stratám, čo spôsobuje pokles.
Vznik oxidu uhoľnatého CO a uhľovodíkov CH x
Pri spaľovaní zmesi stechiometrického zloženia by mal vznikať neškodný oxid uhličitý CO 2 a vodná para a pri nedostatku vzduchu v dôsledku neúplného horenia časti paliva navyše toxický oxid uhoľnatý CO a nespálené uhľovodíky CH x.
Tieto nebezpečné zložky výfukových plynov sa môžu spáliť a zneškodniť. K tomu je potrebné privádzať čerstvý vzduch špeciálnym kompresorom K (obr. 2) na miesto vo výfukovom potrubí, kde sa môžu spaľovať škodlivé splodiny nedokonalého spaľovania. Niekedy sa na to privádza vzduch priamo do horúceho výfukového ventilu.
Tepelný reaktor na dodatočné spaľovanie CO a CH x je spravidla umiestnený bezprostredne za motorom priamo na výstupe výfukových plynov z neho. Výfukové plyny M sú privádzané do stredu reaktora a odvádzané z jeho obvodu do výfukového potrubia V. Vonkajší povrch reaktora má tepelnú izoláciu I.
V najviac vykurovanej centrálnej časti reaktora je umiestnená plameňová komora vyhrievaná výfukovými plynmi, kde dochádza k dohoreniu produktov nedokonalého spaľovania paliva. V tomto prípade sa uvoľňuje teplo, ktoré udržuje vysokú teplotu reaktora.
Nespálené zložky vo výfukových plynoch môžu byť oxidované bez spaľovania pomocou katalyzátora. K tomu je potrebné pridávať do výfukových plynov sekundárny vzduch, ktorý je potrebný na oxidáciu, ktorej chemickú reakciu uskutoční katalyzátor. Taktiež uvoľňuje teplo. Katalyzátorom sú zvyčajne vzácne a drahé kovy, takže je veľmi drahý.
Katalyzátory môžu byť použité v akomkoľvek type motora, ale majú relatívne krátku životnosť. Ak je v palive prítomné olovo, povrch katalyzátora sa rýchlo otrávi a stane sa nepoužiteľným. Získanie vysokooktánového benzínu bez olovnatých antidetonačných činidiel je pomerne komplikovaný proces, pri ktorom sa spotrebuje veľa ropy, čo pri jej nedostatku nie je ekonomicky realizovateľné. Je zrejmé, že dodatočné spaľovanie paliva v tepelnom reaktore vedie k energetickým stratám, hoci pri spaľovaní sa uvoľňuje teplo, ktoré je možné využiť. Preto je vhodné organizovať proces v motore tak, aby pri spaľovaní paliva v ňom vznikalo minimálne množstvo škodlivých látok. Zároveň je potrebné poznamenať, že použitie katalyzátorov bude nevyhnutné pre splnenie sľubných legislatívnych požiadaviek.
Tvorba oxidov dusíka NO x
Škodlivé oxidy dusíka vznikajú pri vysokých teplotách spaľovania za podmienok stechiometrického zloženia zmesi. Zníženie emisií zlúčenín dusíka je spojené s určitými ťažkosťami, pretože podmienky na ich zníženie sa zhodujú s podmienkami pre vznik škodlivé produkty nedokonalé spaľovanie a naopak. Súčasne je možné znížiť teplotu spaľovania zavedením určitého inertného plynu alebo vodnej pary do zmesi.
Na tento účel je účelné recirkulovať ochladené výfukové plyny do sacieho potrubia. Výsledný znížený výkon si vyžaduje obohatenú zmes, väčší otvor škrtiacej klapky, čo zvyšuje celkové emisie škodlivých CO a CH x s výfukovými plynmi.
Recirkulácia výfukových plynov v kombinácii so znížením kompresného pomeru, variabilným časovaním ventilov a oneskoreným zapaľovaním môže znížiť NOx až o 80 %.
Oxidy dusíka sa z výfukových plynov odstraňujú aj pomocou katalytických metód. V tomto prípade výfukové plyny najskôr prechádzajú cez redukčný katalyzátor, v ktorom sa znižuje obsah NOx, a potom spolu s dodatočným vzduchom cez oxidačný katalyzátor, kde sa eliminujú CO a CHx. Schéma takéhoto dvojzložkového systému je znázornená na obr. 3.
Na zníženie obsahu škodlivých látok vo výfukových plynoch sa používajú takzvané α-sondy, ktoré je možné použiť aj v spojení s dvojcestným katalyzátorom. Zvláštnosťou systému α-sondy je, že ku katalyzátoru sa neprivádza dodatočný vzduch na oxidáciu, ale α-sonda neustále monitoruje obsah kyslíka vo výfukových plynoch a riadi prívod paliva tak, aby zmes bola vždy stechiometrická. V tomto prípade budú CO, CH x a NO x prítomné vo výfukových plynoch v minimálnych množstvách.
Princíp činnosti α-sondy spočíva v tom, že v úzkom rozsahu blízko stechiometrického zloženia zmesi α = 1 sa prudko mení napätie medzi vnútorným a vonkajším povrchom sondy, čo slúži ako riadiaci impulz pre zariadenie, ktoré reguluje prívod paliva. Citlivý prvok 1 sondy je vyrobený z oxidu zirkoničitého a jeho povrch 2 je potiahnutý vrstvou platiny. Charakteristiky napätia U medzi vnútorným a vonkajším povrchom snímacieho prvku sú znázornené na obr. 4.
Iné toxické látky
Na zvýšenie oktánového čísla paliva sa zvyčajne používajú antidetonačné činidlá, ako je tetraetylolovo. Aby sa zlúčeniny olova neusádzali na stenách spaľovacej komory a ventilov, používajú sa takzvané lapače, najmä dibrometyl.
Tieto zlúčeniny sa dostávajú do atmosféry s výfukovými plynmi a znečisťujú vegetáciu pozdĺž ciest. Zlúčeniny olova, ktoré sa dostanú do ľudského tela s jedlom, nepriaznivo ovplyvňujú jeho zdravie. Ukladanie olova v katalyzátoroch výfukových plynov už bolo spomenuté. V tomto smere je v súčasnosti dôležitou úlohou odstraňovanie olova z benzínu.
Olej prenikajúci do spaľovacieho priestoru nie je úplne spálený a zvyšuje sa obsah CO a CH x vo výfukových plynoch. Na elimináciu tohto javu je potrebná vysoká tesnosť piestnych krúžkov a udržiavanie dobrého technického stavu motora.
Spaľovanie veľkého množstva oleja je bežné najmä v dvojtaktných motoroch, kde sa olej pridáva do paliva. Negatívne dôsledky používania benzínovo-olejových zmesí čiastočne zmierňuje dávkovanie oleja špeciálnou pumpou podľa zaťaženia motora. Podobné ťažkosti existujú pri použití Wankelovho motora.
Benzínové výpary majú škodlivý vplyv aj na ľudské zdravie. Odvetrávanie kľukovej skrine sa preto musí vykonávať tak, aby sa plyny a pary prenikajúce do kľukovej skrine v dôsledku zlej tesnosti nedostali do atmosféry. Úniku benzínových pár z palivovej nádrže je možné zabrániť adsorpciou a nasávaním pár do sacieho systému. Únik oleja z motora a prevodovky, znečistenie vozidla olejom v dôsledku toho je tiež zakázané z dôvodu zachovania čistoty životného prostredia.
Zníženie spotreby ropy je z ekonomického hľadiska rovnako dôležité ako úspora paliva, keďže oleje sú oveľa drahšie ako palivo. Vykonávanie pravidelného monitorovania a Údržba zníženie spotreby oleja v dôsledku porúch motora. Úniky oleja v motore je možné pozorovať napríklad v dôsledku zlej tesnosti krytu hlavy valcov. V dôsledku úniku oleja je motor znečistený, čo môže spôsobiť požiar.
Únik oleja je tiež nebezpečný z dôvodu nízkej tesnosti tesnenia kľukového hriadeľa. Spotreba oleja sa v tomto prípade výrazne zvyšuje a auto zanecháva na ceste špinavé stopy.
Kontaminácia auta olejom je veľmi nebezpečná a olejové škvrny pod autom sú dôvodom na zákaz jeho prevádzky.
Olej unikajúci z tesnenia kľukového hriadeľa sa môže dostať do spojky a spôsobiť jej preklzávanie. Negatívnejšie dôsledky však spôsobuje vstup oleja do spaľovacej komory. A hoci je spotreba oleja relatívne malá, ale jeho nedokonalé spaľovanie zvyšuje emisie škodlivých zložiek s výfukovými plynmi. Spaľovanie oleja sa prejavuje nadmernou dymivosťou áut, ktorá je typická pre, ako aj výrazne opotrebované štvortaktné motory.
V štvortaktných motoroch sa olej dostáva do spaľovacieho priestoru cez piestne krúžky, čo je badateľné najmä vtedy, keď sú spolu s valcom veľmi opotrebované. Hlavným dôvodom prenikania oleja do spaľovacej komory je nerovnomerné uloženie kompresných krúžkov k obvodu valca. Olej sa vypúšťa zo stien valca cez štrbiny krúžku na stieranie oleja a otvory v jeho drážke.
Cez medzeru medzi driekom a vedením sacieho ventilu ľahko preniká olej do sacieho potrubia, kde je podtlak. To platí najmä pri použití olejov s nízkou viskozitou. Prúdeniu oleja cez túto zostavu možno zabrániť použitím gumového tesnenia na konci vodidla ventilu.
Plyny z kľukovej skrine motora obsahujúce veľa škodlivých látok sa zvyčajne odvádzajú špeciálnym potrubím do sacieho systému. Plyny z kľukovej skrine, ktoré z neho prichádzajú do valca, horia spolu so zmesou vzduchu a paliva.
Oleje s nízkou viskozitou znižujú straty trením, zlepšujú motory a znižujú spotrebu paliva. Neodporúča sa však používať oleje s viskozitou nižšou, ako predpisujú normy. To môže spôsobiť zvýšenú spotrebu oleja a vysoké opotrebovanie motora.
Vzhľadom na potrebu šetriť ropu sa zber a používanie odpadových olejov stáva čoraz dôležitejšou otázkou. Regeneráciou starých olejov je možné získať značné množstvo kvalitných tekutých mazív a zároveň zabrániť znečisťovaniu životného prostredia zastavením vypúšťania použitých olejov do vodných tokov.
Stanovenie prípustného množstva škodlivých látok
Odstránenie škodlivých látok z výfukových plynov je pomerne náročná úloha. Vo vysokých koncentráciách sú tieto zložky zdraviu veľmi škodlivé. Samozrejme, nie je možné okamžite zmeniť súčasný stav, najmä vo vzťahu k prevádzkovanému vozovému parku. Preto sú právne predpisy na kontrolu obsahu škodlivých látok vo výfukových plynoch určené pre novovyrobené vozidlá. Tieto predpisy sa budú postupne zlepšovať s prihliadnutím na nové úspechy vo vede a technike.
Čistenie výfukových plynov je spojené so zvýšením spotreby paliva takmer o 10 %, znížením výkonu motora a zvýšením ceny automobilu. Zároveň sa zvyšujú aj náklady na údržbu auta. Katalyzátory sú tiež drahé, pretože ich komponenty sú tvorené vzácnymi kovmi. Životnosť by sa mala rátať na 80 000 km auta, no teraz sa ešte nedosiahla. V súčasnosti používané katalyzátory vydržia asi 40 000 km a používa sa bezolovnatý benzín.
Súčasná situácia spochybňuje účinnosť prísnych predpisov o obsahu škodlivých nečistôt, pretože to spôsobuje výrazné zvýšenie nákladov na automobil a jeho prevádzku a tiež vedie k zvýšená spotreba oleja.
Splnenie prísnych požiadaviek kladených do budúcnosti na čistotu výfukových plynov pri súčasnom stave benzínových a naftových motorov zatiaľ nie je možné. Preto je vhodné venovať pozornosť radikálnej zmene pohonu mechanických vozidiel.
VLOOKUP. Chémia. Kód 11. stupňa
11. STUPEŇ Vysvetlivky k vzorke celoruskej testovacej práce Pri prezeraní vzorky testovacej práce treba mať na pamäti, že úlohy zahrnuté vo vzorke neodrážajú všetky zručnosti a obsahové problémy, ktoré budú testované ako súčasť celoruskej testovacej práce. Úplný zoznam obsahové prvky a zručnosti, ktoré je možné v práci vyskúšať, sú uvedené v kodifikátore obsahových prvkov a požiadaviek na úroveň prípravy absolventov pre vypracovanie celoruského testovacieho diela z chémie. Účelom vzorky testovacej práce je poskytnúť predstavu o štruktúre celoruskej testovacej práce, počte a forme úloh a ich úrovni zložitosti.
VLOOKUP. Chémia. Kód 11. stupňa
© 2017 federálna služba pre supervíziu vo vzdelávaní a vede Ruská federácia VŠEOBECNÁ OVEROVACIA PRACOVNÁ CHÉMIA
11 VZOR TRIEDY Pokyny na vykonanie práce Skúšobná práca obsahuje 15 úloh. Na vypracovanie práce z chémie je pridelených 1 hodina 30 minút (90 minút) (90 minút. Odpovede doplňte v texte práce podľa pokynov k úlohám. Ak napíšete nesprávnu odpoveď, prečiarknite a napíšte pri práci môžete použiť nasledujúce doplnkové materiály
– Periodický systém chemické prvky D.I. Mendelejev
- tabuľka rozpustnosti solí, kyselín a zásad vstupujúcich do elektrochemického radu napätí kovov
- neprogramovateľná kalkulačka. Pri dokončovaní úloh môžete použiť koncept. Koncepty nebudú kontrolované ani hodnotené. Odporúčame vám dokončiť úlohy v poradí, v akom sú zadané. Ak chcete ušetriť čas, preskočte úlohu, ktorá sa nedá dokončiť hneď, a prejdite na ďalšiu. Ak vám po dokončení všetkej práce zostane čas, môžete sa vrátiť k zmeškaným úlohám. Body, ktoré získate za splnené úlohy, sa sčítajú. Pokúste sa splniť čo najviac úloh a získať čo najviac bodov. Prajeme vám úspech
VLOOKUP. Chémia. Kód 11. stupňa
© 2017 Federálna služba pre dohľad nad školstvom a vedou Ruskej federácie Z kurzu chémie poznáte nasledujúce metódy delenia zmesí: sedimentácia, filtrácia, destilácia (destilácia, magnetické pôsobenie, odparovanie, kryštalizácia. Príklady na obrázkoch 1–3 použitia niektorých z týchto metód. Obr. 1 Obr. 2 Obr
Ktorý z nasledujúcich spôsobov separácie zmesí možno použiť na čistenie?
1) múka zo železných pilín, ktoré vypadli von
2) voda z anorganických solí v nej rozpustených Zapíšte číslo obrázku a názov zodpovedajúcej metódy delenia zmesi do tabuľky. Zmes Číslo obrázku Spôsob oddeľovania zmesi Múka a železné piliny, ktoré spadli mimo Voda s anorganickými soľami rozpustenými v nej Na obrázku je znázornený model elektrónovej štruktúry atómu niektorých chemický prvok. Na základe analýzy navrhovaného modelu vykonajte nasledujúce úlohy) určte chemický prvok, ktorého atóm má takúto elektrónovú štruktúru
2) uveďte číslo periódy a číslo skupiny v periodickom systéme chemických prvkov D.I. Mendelejev, v ktorom sa tento prvok nachádza
3) určiť, či jednoduchá látka, ktorá tvorí tento chemický prvok, patrí medzi kovy alebo nekovy. Zaznamenajte svoje odpovede do tabuľky. Odpoveď Symbol chemického prvku
číslo obdobia
Skupina č Kov nekov
1
2
VLOOKUP. Chémia. Kód 11. stupňa
© 2017 Federálna služba pre dohľad nad vzdelávaním a vedou Ruskej federácie Periodická tabuľka chemických prvkov D.I. Mendelejev je bohatým zdrojom informácií o chemických prvkoch, ich vlastnostiach a vlastnostiach ich zlúčenín, o spôsoboch zmeny týchto vlastností, metódach získavania látok a o ich prítomnosti v prírode. Napríklad je známe, že s nárastom poradového čísla chemického prvku v periódach sa polomery atómov zmenšujú a v skupinách sa zväčšujú. Vzhľadom na tieto vzorce usporiadajte v poradí rastúcich polomerov atómov nasledujúce prvky N, C, Al, Si. Zapíšte si označenia prvkov v správnom poradí. Odpoveď ____________________________ Tabuľka nižšie uvádza charakteristické vlastnosti látky, ktoré majú molekulárnu a iónovú štruktúru. Charakteristické vlastnosti látok Molekulárna štruktúra Iónová štruktúra má za normálnych podmienok kvapalný, plynný a pevný stav agregácie majú nízke teploty varu a topenia
nevodivé; majú nízku tepelnú vodivosť
tuhá látka za normálnych podmienok krehká žiaruvzdorná neprchavá v taveninách a roztokoch elektriny Pomocou týchto informácií určite, akú štruktúru majú látky dusík a kuchynská soľ NaCl. Svoju odpoveď napíšte na určené miesto
1) dusík N
2
________________________________________________________________
2) kuchynská soľ NaCl __________________________________________________
3
4
VLOOKUP. Chémia. Kód 11. stupňa
© 2017 Federálna služba pre dohľad nad vzdelávaním a vedou Ruskej federácie Komplexné anorganické látky možno podmienečne distribuovať, to znamená klasifikovať, do štyroch skupín, ako je znázornené na obrázku. V tomto grafe pre každú zo štyroch skupín doplňte chýbajúce názvy skupín resp chemické vzorce látky (jeden príklad vzorcov patriacich do tejto skupiny. Prečítajte si nasledujúci text a vykonajte úlohy 6-8. Potravinársky priemysel používa potravinársku prísadu E, ktorou je hydroxid vápenatý Ca (OH)
2
. Uplatnenie nachádza pri výrobe ovocných štiav, detskej výživy, nakladaných uhoriek, jedlej soli, cukrovinky a sladkosti. Príprava hydroxidu vápenatého v priemyselnom meradle prípadne zmiešaním oxidu vápenatého s vodou, proces nazývaný kalenie. Hydroxid vápenatý sa vo veľkej miere používa pri výrobe takýchto látok stavebné materiály ako vápno, omietka a sadrové malty. Je to kvôli jeho schopnosti interagovať s oxidom uhličitým CO
2
obsiahnuté vo vzduchu. Rovnaká vlastnosť roztoku hydroxidu vápenatého sa používa na meranie množstva oxidu uhličitého vo vzduchu. Užitočný majetok hydroxid vápenatý je jeho schopnosť pôsobiť ako flokulant, ktorý čistí odpadovú vodu od suspendovaných a koloidných častíc (vrátane solí železa. Používa sa aj na zvýšenie pH vody, keďže prírodná voda obsahuje látky (napríklad kyseliny spôsobujúce koróziu vodovodných potrubí). .
5
VLOOKUP. Chémia. Kód 11. stupňa
© 2017 Federálna služba pre dohľad vo vzdelávaní a vede Ruskej federácie
6 1. Napíšte molekulovú rovnicu pre reakciu výroby hydroxidu vápenatého uvedenú v texte. Odpoveď
2. Vysvetlite, prečo sa tento proces nazýva kalenie. Odpoveď
________________________________________________________________________________
1. Vytvorte molekulovú rovnicu pre reakciu medzi hydroxidom vápenatým a oxidom uhličitým, ktorá bola uvedená v texte. Odpoveď
2. Vysvetlite, aké vlastnosti tejto reakcie umožňujú jej využitie na zistenie oxidu uhličitého vo vzduchu. Odpoveď
________________________________________________________________________________
________________________________________________________________________________
1. Napíšte skrátenú iónovú rovnicu pre reakciu medzi hydroxidom vápenatým a kyselinou chlorovodíkovou uvedenou v texte. Odpoveď
2. Vysvetlite, prečo sa táto reakcia používa na zvýšenie pH vody. Odpoveď
________________________________________________________________________________
________________________________________________________________________________
6
7
8
VLOOKUP. Chémia. Kód 11. stupňa
© 2017 Federálna služba pre dohľad nad vzdelávaním a vedou Ruskej federácie Je uvedená schéma redoxnej reakcie.
H
2
S + Fe
2
O
3
→ FeS + S + H
2
O
1. Urobte elektronickú rovnováhu tejto reakcie. Odpoveď
2. Špecifikujte oxidačné činidlo a redukčné činidlo. Odpoveď
3. Usporiadajte koeficienty v rovnici reakcie. Odpoveď Daná schéma transformácií
Fe Napíšte molekulové rovnice reakcií, ktorými možno tieto premeny uskutočniť.
1) _________________________________________________________________________
2) _________________________________________________________________________
3) _________________________________________________________________________ Vytvorte súlad medzi vzorcom organickej hmoty a triedu/skupinu, do ktorej látka patrí do každej polohy označenej písmenom, vyberte zodpovedajúcu polohu označenú číslom. LÁTKA
TRIEDA/SKUPINA A)
CH
3
-CH
2
-CH
3
B) C)
CH
3
-CH
2
Oh
1) nasýtené uhľovodíky
2) alkoholy
3) nenasýtené uhľovodíky
4) karboxylové kyseliny Zapíšte do tabuľky vybrané čísla pod príslušné písmená. A B C Odpoveď
9
10
11
VLOOKUP. Chémia. Kód 11. stupňa
© 2017 Federálna služba pre dohľad nad vzdelávaním a vedou Ruskej federácie K navrhovaným schémam chemické reakcie vložte vzorce chýbajúcich látok a usporiadajte koeficienty.
1) C
2
H
6
+ ........................ → C
2
H
5
Cl + HCl
2) C
3
H
6
+ ….................. → CO
2
+ H
2
O Propán horí s nízkou emisiou toxických látok do atmosféry, preto sa používa ako zdroj energie v mnohých oblastiach, napríklad v plynových zapaľovačoch a na vykurovanie vidieckych domov. Aký objem oxidu uhličitého (plynu) vznikne pri úplnom spálení 4,4 g propánu Napíšte podrobné riešenie úlohy. Odpoveď
________________________________________________________________________________
________________________________________________________________________________ Izopropylalkohol používa sa ako univerzálne rozpúšťadlo, je súčasťou domácich chemikálií, parfumov a kozmetiky, kvapalín do ostrekovačov automobilov. V súlade s nižšie uvedenou schémou zostavte rovnice pre reakcie na získanie tohto alkoholu. Pri písaní reakčných rovníc používajte štruktúrne vzorce organických látok.
CH
2
CH CH
3
CH
3
CCH
3
O
CH
3
CH CH
3
Br
CH
3
CH
CH
3
Oh
1) _______________________________________________________
2) _______________________________________________________
3) _______________________________________________________
12
13
14
VLOOKUP. Chémia. Kód 11. stupňa
© 2017 Federálna služba pre dohľad nad vzdelávaním a vedou Ruskej federácie Fyziologický soľný roztok v medicíne sa nazýva 0,9% roztok chloridu sodného vo vode. Vypočítajte hmotnosť chloridu sodného a hmotnosť vody potrebnej na prípravu
500 g fyziologického roztoku. Napíšte podrobné riešenie problému. Odpoveď
________________________________________________________________________________
________________________________________________________________________________
15
VLOOKUP
. Chémia. 11. ročník Odpovede 2017 Federálna služba pre dohľad vo vzdelávaní a vede Ruskej federácie VŠEOBECNÉ RUSKÉ OVEROVACIE PRÁCE
CHÉMIA
, 11
TRIEDA
Odpovedzte
ety
a hodnotiace kritériá
ania
№
úlohy
Odpovedzte
č
1
Zmes
číslo
kreslenie
spôsob
oddelenie
zmesi
Múčne a železné piliny, ktoré vypadli mimo pôsobenia magnetu
Voda s rozpustenými anorganickými soľami
Destilácia
(destilácia
2
N; 2; 5 (alebo V); nekovové N
→
C
→
Si
→
Al
4 dusík N
2
– molekulová štruktúra kuchynská soľ NaCl – iónová štruktúra 132 Správna odpoveď na úlohu 3 sa odhaduje jedným bodom
Splnenie úloh 1, 2, 4, 11 sa hodnotí takto 2 body - bez chýb
1 bod - urobila sa jedna chyba 0 bodov - urobila sa dve alebo viac chýb alebo neexistuje žiadna odpoveď
Obsah
správna odpoveď a pokyny na hodnotenie
n
júla
Body
Prvky odpovede Názvy základných skupín sú napísané, soli sú vzorce látok zodpovedajúcich skupín
Odpoveď je správna a úplná, obsahuje všetky vyššie uvedené prvky Tri bunky schémy sú správne vyplnené 1 Vyskytli sa dve alebo viac chýb Maximálne skóre
5
VLOOKUP
. Chémia. 11. ročník Odpovede 2017 Federálna služba pre dohľad nad vzdelávaním a vedou Ruskej federácie Obsah správnej odpovede a pokyny na vyhodnotenie
n
júla
(navyše sú použité iné znenia odpovede, ktoré neskresľujú jej význam
Body
Prvky odozvy
1) CaO + H
2
O = Ca(
oh)
2 2) Pri interakcii oxidu vápenatého s vodou sa uvoľňuje veľké množstvo tepla, takže voda vrie a syčí, ako keby narážala na žeravé uhlie, keď je oheň uhasený vodou (
alebo
„Tento proces sa nazýva hasenie, pretože v dôsledku toho vzniká hasené vápno
»)
Odpoveď je správna a úplná, obsahuje všetky vyššie uvedené prvky Odpoveď obsahuje jeden z vyššie uvedených prvkov 1 Všetky prvky odpovede sú napísané nesprávne 0 Maximálne skóre 2 Obsah správnej odpovede a pokyny na bodovanie
n
júla
(navyše sú použité iné znenia odpovede, ktoré neskresľujú jej význam
Body
Prvky odozvy
1) Ca(OH)
2
+ CO
2
= CaCO
3
↓+H
2
O
2) V dôsledku tejto reakcie vzniká nerozpustná látka uhličitan vápenatý, pozoruje sa zakalenie východiskového roztoku, čo umožňuje posúdiť prítomnosť oxidu uhličitého vo vzduchu Kvalitatívna reakcia na Odpoveď je správna a úplná , obsahuje všetky vyššie uvedené prvky Odpoveď obsahuje jeden z vyššie uvedených prvkov 1 Všetky prvky odpovede sú napísané nesprávne 0 Maximálne skóre 2 Obsah správnej odpovede a pokyny na bodovanie
n
júla
(navyše sú použité iné znenia odpovede, ktoré neskresľujú jej význam
Body
Prvky odozvy
1) OH
–
+ H
+
= H
2
O
2) Prítomnosť kyselín v prírodnej vode spôsobuje nízke hodnoty tejto vody
hydroxid vápenatý
neutralizácia
č
kyslé
odo
a hodnoty sa zvyšujú Odpoveď je správna a úplná, obsahuje všetky vyššie uvedené prvky Odpoveď obsahuje jeden z vyššie uvedených prvkov 1 Všetky prvky odpovede sú napísané nesprávne 0 Maximálne skóre 2
6
7
8
VLOOKUP
n
júla
(navyše sú použité iné znenia odpovede, ktoré neskresľujú jej význam
Body
1) Zostavené elektronické váhy) Uvádza sa, že síra v oxidačnom stave –2 (alebo H
2
S) je redukčné činidlo, zatiaľ čo železo v oxidačnom stave +3 alebo Fe
2
O
3
) je oxidačné činidlo
3) Zostavená reakčná rovnica
3H
2
S + Fe
2
O
3
= 2FeS + S + 3
H
2
O Odpoveď je správna a úplná, obsahuje všetky vyššie uvedené prvky Dva z vyššie uvedených prvkov odpovede sú správne napísané 2 Jeden z vyššie uvedených prvkov odpovede je napísaný správne 1 Všetky prvky odpovede sú napísané nesprávne 0 Maximálne skóre Obsah správnej odpovede a pokyny na bodovanie
n
júla
Body
Reakčné rovnice sú napísané podľa schémy transformácie
1) Fe + 2HCl = FeCl
2
+ H
2 2) FeCl
2
+ 2 AgNO
3
= Fe(NO
3
2
+ 2Ag
C
l
3) Fe(NO
3
2
+ 2 KOH = F
e(OH)
2
.)
n
júla
Body
Prvky odozvy
1)
S
2
H
6
+Cl
2
→
S
2
H
5
Cl + HCl
2) 2C
3
H
6
+ 90
2
→
6C
O
2
+ 6
H
2
O Zlomkové koeficienty sú možné) Odpoveď je správna a úplná, obsahuje všetky vyššie uvedené prvky V jednom z prvkov odpovede sa vyskytla chyba 1 Všetky prvky odpovede sú napísané nesprávne 0 Maximálne skóre
9
10
12
VLOOKUP
. Chémia. 11. ročník Odpovede 2017 Federálna služba pre dohľad nad vzdelávaním a vedou Ruskej federácie Obsah správnej odpovede a pokyny na vyhodnotenie
n
júla
(navyše sú použité iné znenia odpovede, ktoré neskresľujú jej význam
Body
1) Rovnica reakcie spaľovania propánu
S
3
H
8
+ O →
CO + HO) n(
S
3
H
8
) \u003d 4,4 / 44 \u003d 0,1 mol COCH mol) O) \u003d 0,3 22,4 \u003d 6,72 l Odpoveď je správna a úplná, obsahuje všetky vyššie uvedené prvky Dva z vyššie uvedených prvkov odpovede sú správne napísané 2 Opravte jeden z vyššie uvedených prvky odpovede sú zaznamenané 1 Všetky prvky odpovede sú napísané nesprávne 0 Maximálne skóre 3 Obsah správnej odpovede a pokyny na bodovanie
n
júla
Body
Reakčné rovnice sú napísané podľa schémy
1)
C
H
3
CH
CH
2
+ H
2
O
H
2
SO
4
, t
°
CH
3
CH
CH
3
Oh
CH
3
CC
H
3
O
+ mačka + voda n. r-r,
t
°
+ Sú povolené iné, ktoré nie sú v rozpore s podmienkou stanovenia reakčnej rovnice
.)
Tri reakčné rovnice sú napísané správne Dve reakčné rovnice sú napísané správne 2 Jedna reakčná rovnica je napísaná správne 1 Všetky rovnice sú napísané nesprávne alebo neexistuje žiadna odpoveď 0 Maximálne skóre Obsah správnej odpovede a návod na vyhodnotenie
n
júla
(navyše sú použité iné znenia odpovede, ktoré neskresľujú jej význam
Body
Prvky odozvy
1) m
(NaCI) = 4,5 g
2) voda) = 495,5 g
Odpoveď je správna a úplná, obsahuje všetky vyššie uvedené prvky Odpoveď obsahuje jeden z vyššie uvedených prvkov 1 Všetky prvky odpovede sú napísané nesprávne 0 Maximálne skóre 2
13
14
15
Od roku 1965 do roku 1980 na celom svete z 1 307 úmrtí pri veľkých nehodách zahŕňajúcich požiare, výbuchy alebo úniky toxických látok, či už v pevných zariadeniach, alebo počas prepravy, 104 úmrtí (8 %) súvisí s uvoľnením toxickej látky. Štatistika nefatálnych prípadov je nasledovná: celkový počet postihnutých je 4285 ľudí, 1343 ľudí (32 %) trpelo toxickými emisiami. Pred rokom 1984 bol pomer obetí a úmrtí spôsobených únikom toxických látok veľmi odlišný od pomeru nehôd s požiarmi a výbuchmi. Nehoda, ku ktorej došlo 3. decembra 1984 v meste Bhópál (India), si však vyžiadala asi 4 tisíc obetí a tento pomer výrazne napravila. Nehody spojené s únikom toxických látok vyvolávajú veľké obavy verejnosti vo všetkých priemyselných krajinách.
Mnohé toxické látky široko používané v priemysle, z ktorých najvýznamnejšie sú chlór a amoniak, sa skladujú ako skvapalnené plyny pod tlakom minimálne 1 MPa. V prípade straty tesnosti nádrží, kde je takáto látka skladovaná, dochádza k okamžitému odpareniu časti kvapaliny. Množstvo odparenej kvapaliny závisí od povahy látky a jej teploty. Niektoré toxické látky, ktoré sú pri bežných teplotách kvapalné, sa skladujú v nádržiach (pod atmosferický tlak) vybavené dýchacími armatúrami a vhodnými zariadeniami na zabránenie úniku do atmosféry, ako je špeciálny lapač aktívneho uhlia. Jeden z možné príčiny strata tesnosti nádrže môže byť prejavom nadmerného tlaku inertného plynu, ako je dusík, vo vnútri parného priestoru nádrže, ku ktorému dochádza v dôsledku zlyhania redukčného ventilu pri absencii automatického tlaku riadiaci systém v nádrži. Ďalším dôvodom je prenášanie zvyškov toxickej látky spolu s vodou, napríklad pri splachovaní nádrže.
Možnou príčinou úniku z nádrží môže byť prebytočné teplo dodávané do nádrže, napríklad vo forme slnečného žiarenia alebo tepelného zaťaženia požiarom v skladovacom priestore. Látky, ktoré chemicky reagujú s obsahom, môžu tiež spôsobiť toxické uvoľnenie v nádrži, aj keď samotný obsah má nízku toxicitu. Existujú prípady, keď podniky v dôsledku neúmyselných akcií, napríklad pri miešaní kyseliny chlorovodíkovej a bielidlo (chlórnan sodný), výsledný chlór unikal. Látky, ktoré urýchľujú polymerizáciu alebo rozklad, môžu byť uvoľnené do nádrže, aby sa uvoľnilo dostatok tepla, aby sa časť obsahu vyvarila a uvoľnili toxické látky.
Vyšetrenie č. 1 11 buniek
Možnosť 1.
Z kurzu chémie viete nasledovnéspôsoby separácia zmesí:
.
spôsoby.


Obr.1 Obr.2 Obr.3
1) múka zo železných pilín, ktoré sa do nej dostali;
2) voda z anorganických solí v nej rozpustených?
zmesi. (
Múka a v nej zachytenéželezné piliny
Voda s rozpustenými anorganickými soľami
prvok.

tento chemický prvok.
Svoje odpovede zapíšte do tabuľky
Symbolchemický
prvok
číslo obdobia
číslo skupiny
Kovové/nekovové
3. Periodický systém chemických prvkov D.I. Mendelejev - bohaté úložisko
o ich prítomnosti v prírode. Napríklad je známe, že so zvyšujúcim sa sériovým číslom
chemický prvok v periódach sa polomery atómov zmenšujú a v skupinách zväčšujú.
Vzhľadom na tieto vzory usporiadajte v poradí podľa rastúcich atómových polomerov
nasledujúce prvky:C, Si, Al, N.
sekvencie.
4.
stav;
varenie a topenie;
nevodivé;
krehký;
žiaruvzdorné;
neprchavý;
elektriny
Pomocou týchto informácií určite štruktúru látok dusík N 2
a kuchynská soľ NaCl. (uveďte podrobnú odpoveď).
2
výrobky a sladkosti.
cez
CO2
oxid uhličitý vo vzduchu.
obsahuje látky (napr.kyseliny
uvedené v texte .
6.
.
9. Hoci rastliny a živočíchy potrebujú zlúčeniny fosforu ako prvok, ktorý je súčasťou životne dôležitých látok, znečistenie prírodných vôd fosfátmi má mimoriadne negatívny vplyv na stav vodných útvarov. Vypúšťanie fosfátov s odpadovými vodami spôsobuje rýchly vývoj modrozelených rias a je inhibovaná životná aktivita všetkých ostatných organizmov. Určte počet katiónov a aniónov vzniknutých pri disociácii 25 mol ortofosforečnanu sodného.
10. Uveďte vysvetlenie:Niekedy v vidiekženy kombinujú farbenie vlasov henou s umývaním v ruskom kúpeli. Prečo je sfarbenie intenzívnejšie?
11.
H 2 S + Fe 2 O 3 → FeS + S + H 2 O.
12. Propán horí s nízkou úrovňou emisií toxických látok do atmosféry, preto sa používa ako zdroj energie v mnohých oblastiach, napríklad v plyne
Aký objem oxidu uhličitého (N.O.) vznikne pri úplnom spálení 4,4 g propánu?
13. Soľný roztok v medicíne sa nazýva 0,9% roztok chloridu sodného vo vode. Vypočítajte hmotnosť chloridu sodného a hmotnosť vody potrebnej na prípravu 500 g fyziologického roztoku.
Napíšte podrobné riešenie problému .
Vyšetrenie č. 1 11 buniek
Možnosť 2.
1. Z kurzu chémie viete nasledovnéspôsoby separácia zmesí:
usadzovanie, filtrovanie, destilácia (destilácia), pôsobenie magnetu, odparovanie, kryštalizácia .
Obrázky 1-3 poskytujú príklady niektorých z uvedených
spôsoby.


Obr.1 Obr.2 Obr.3
Ktorú z nasledujúcich metód separácie zmesí možno použiť na čistenie:
1) síra zo železných pilín, ktoré sa do nej dostali;
2) voda z častíc hliny a piesku?
Do tabuľky napíšte číslo obrázku a názov zodpovedajúcej separačnej metódy.
zmesi. (prekresliť tabuľku do zošita)
2. Na obrázku je znázornený model elektrónovej štruktúry atómu nejakej chemikálie
prvok.

Na základe analýzy navrhovaného modelu vykonajte nasledujúce úlohy:
1) určiť chemický prvok, ktorého atóm má takúto elektrónovú štruktúru;
2) uveďte číslo periódy a číslo skupiny v periodickom systéme chemikálií
prvky D.I. Mendelejev, v ktorom sa tento prvok nachádza;
3) určiť, či jednoduchá látka patrí medzi kovy alebo nekovy, ktoré tvoria
tento chemický prvok.
Svoje odpovede zapíšte do tabuľky(nakreslite tabuľku do zošita)
Symbolchemický
prvok
číslo obdobia
číslo skupiny
Kovové/nekovové
3. Periodický systém chemických prvkov D.I. Mendelejev - bohaté úložisko
informácie o chemických prvkoch, ich vlastnostiach a vlastnostiach ich zlúčenín,
o zákonitostiach zmien týchto vlastností, o metódach získavania látok, ako aj
o ich prítomnosti v prírode. Napríklad je známe, že elektronegativita chemického prvku sa zvyšuje v periódach a znižuje sa v skupinách.
Vzhľadom na tieto vzorce usporiadajte v poradí so zvyšujúcou sa elektronegativitou
nasledujúce prvky:F, Na, N, Mg. Zapíšte si označenie prvkov v požadovanom
sekvencie.
4. V tabuľke nižšie sú uvedené charakteristické vlastnosti látok, ktoré majú molekulárnu a iónovú štruktúru.
za normálnych podmienok mať kvapalinu,plynný a pevný agregát
stav;
mať nízke teploty
varenie a topenie;
nevodivé;
majú nízku tepelnú vodivosť
za normálnych podmienok tuhá;
krehký;
žiaruvzdorné;
neprchavý;
v taveninách a roztokoch
elektriny
Pomocou týchto informácií určite štruktúru látok kyslík O 2
a sóda Na 2 CO 3 . (uveďte podrobnú odpoveď).
V potravinárskom priemysle sa používa potravinárska prídavná látka E526, ktorá
je hydroxid vápenatý Ca(OH)2 . Uplatnenie nachádza pri výrobe:
ovocné šťavy, detská výživa, nakladané uhorky, jedlá soľ, cukrovinky
výrobky a sladkosti.
Výroba hydroxidu vápenatého v priemyselnom meradle je možnácez
zmiešanie oxidu vápenatého s vodou , tento proces sa nazýva kalenie.
Hydroxid vápenatý sa široko používa pri výrobe takýchto stavebných materiálov.
materiály ako vápno, omietka a sadrové malty. Je to kvôli jeho schopnostiam
interagovať s oxidom uhličitým CO2 obsiahnuté vo vzduchu. Rovnaká nehnuteľnosť
Na meranie kvantitatívneho obsahu sa používa roztok hydroxidu vápenatého
oxid uhličitý vo vzduchu.
Užitočnou vlastnosťou hydroxidu vápenatého je jeho schopnosť pôsobiť ako
flokulant, ktorý čistí odpadovú vodu od suspendovaných a koloidných častíc (vrátane
soli železa). Používa sa tiež na zvýšenie pH vody, ako prírodná voda
obsahuje látky (napr.kyseliny ), čo spôsobuje koróziu vo vodovodnom potrubí.
5. Napíšte molekulovú rovnicu reakcie za vzniku hydroxidu vápenatého, ktorý
uvedené v texte .
6. Vysvetlite, prečo sa tento proces nazýva kalenie.
7. Napíšte molekulovú rovnicu pre reakciu medzi hydroxidom vápenatým a oxidom uhličitým
plyn, ktorý bol v texte uvedený. Vysvetlite, aké vlastnosti tejto reakcie umožňujú jej použitie na detekciu oxidu uhličitého vo vzduchu.
8. Zostavte skrátenú iónovú rovnicu reakcie uvedenej v texte medzi
hydroxid vápenatý a kyselina chlorovodíková .
9. Hoci rastliny a živočíchy potrebujú zlúčeniny fosforu ako prvok, ktorý je súčasťou životne dôležitých látok, znečistenie prírodných vôd fosfátmi má mimoriadne negatívny vplyv na stav vodných útvarov. Vypúšťanie fosfátov s odpadovými vodami spôsobuje rýchly vývoj modrozelených rias a je inhibovaná životná aktivita všetkých ostatných organizmov. Určte počet katiónov a aniónov vzniknutých pri disociácii 15 mol ortofosforečnanu draselného.
10. Uveďte vysvetlenie:Prečo sa všetky typy vlasového stylingu zvyčajne robia teplom?
11. Je uvedená schéma redoxnej reakcie
Nastavte pomery. Zapíšte si elektronický zostatok.
Špecifikujte oxidačné činidlo a redukčné činidlo.
12. Propán horí s nízkymi emisiami toxických látok do atmosféry, preto sa využíva ako zdroj energie v mnohých oblastiach, napr.
zapaľovače a pri vykurovaní vidieckych domov.
Aký objem oxidu uhličitého (N.O.) vznikne pri úplnom spálení 5 g propánu?
Napíšte podrobné riešenie problému.
13. Lekárnik potrebuje pripraviť 5% roztok jódu, ktorý sa používa na ošetrenie rán.
Aký objem roztoku môže pripraviť lekárnik z 10 g kryštalického jódu, ak by hustota roztoku mala byť 0,950 g/ml?
Celoruské testovanie práca VLOOKUP Všeruská overovacia práca – chémia 11. ročník
Vysvetlivky k vzorke celoruskej overovacej práce
Pri oboznamovaní sa so vzorovou testovacou prácou je potrebné mať na pamäti, že úlohy zahrnuté vo vzorke neodrážajú všetky zručnosti a problémy s obsahom, ktoré budú testované v rámci celoruskej testovacej práce. Kompletný zoznam obsahových prvkov a zručností, ktoré je možné v práci otestovať, je uvedený v kodifikátore obsahových prvkov a požiadaviek na úroveň prípravy absolventov pre vypracovanie celoruského testovacieho diela z chémie. Účelom vzorky testovacej práce je poskytnúť predstavu o štruktúre celoruskej testovacej práce, počte a forme úloh a ich úrovni zložitosti.
Pracovné pokyny
Testovacia práca obsahuje 15 úloh. Na dokončenie práce v chémii je pridelená 1 hodina 30 minút (90 minút).
Odpovede pripravte v texte práce podľa pokynov k úlohám. Ak napíšete nesprávnu odpoveď, prečiarknite ju a napíšte vedľa nej novú.
Pri vykonávaní práce je povolené používať nasledujúce dodatočné materiály:
– Periodická sústava chemických prvkov D.I. Mendelejev;
- tabuľka rozpustnosti solí, kyselín a zásad vo vode;
– elektrochemický rad napätí kovov;
- neprogramovateľná kalkulačka.
Pri dokončovaní úloh môžete použiť koncept. Koncepty nebudú kontrolované ani hodnotené.
Odporúčame vám dokončiť úlohy v poradí, v akom sú zadané. Ak chcete ušetriť čas, preskočte úlohu, ktorú nemôžete dokončiť hneď, a prejdite na ďalšiu. Ak vám po dokončení všetkej práce zostane čas, môžete sa vrátiť k zmeškaným úlohám.
Body, ktoré získate za splnené úlohy, sa sčítajú. Pokúste sa splniť čo najviac úloh a získať čo najviac bodov.
Prajeme vám úspech!
1. Z kurzu chémie poznáte nasledujúce spôsoby delenia zmesí: sedimentácia, filtrácia, destilácia (destilácia), pôsobenie magnetu, odparovanie, kryštalizácia. Obrázky 1-3 zobrazujú príklady niektorých z týchto metód.
Ktorú z nasledujúcich metód separácie zmesí možno použiť na čistenie:
1) múka zo železných pilín, ktoré sa do nej dostali;
2) voda z anorganických solí v nej rozpustených?
Do tabuľky zapíšte číslo obrázku a názov zodpovedajúcej metódy delenia zmesi.
železné piliny sú priťahované magnetom
pri destilácii po kondenzácii vodnej pary zostávajú v nádobe kryštály soli
2. Na obrázku je znázornený model elektrónovej štruktúry atómu nejakej chemikálieprvok.

Na základe analýzy navrhovaného modelu vykonajte nasledujúce úlohy:
1) určiť chemický prvok, ktorého atóm má takúto elektrónovú štruktúru;
2) uveďte číslo periódy a číslo skupiny v periodickom systéme chemických prvkov D.I. Mendelejev, v ktorom sa tento prvok nachádza;
3) určiť, či jednoduchá látka, ktorá tvorí tento chemický prvok, patrí medzi kovy alebo nekovy.
Zaznamenajte svoje odpovede do tabuľky.
odpoveď:
N; 2; 5 (alebo V); nekovové
na určenie chemického prvku by ste mali vypočítať celkový počet elektrónov, ktorý vidíme na obrázku (7)
z periodickej tabuľky môžeme ľahko určiť prvok (počet nájdených elektrónov sa rovná atómovému číslu prvku) (N-dusík)
potom určíme číslo skupiny (vertikálny stĺpec) (5) a povahu tohto prvku (nekov)
3. Periodický systém chemických prvkov D.I. Mendelejev- bohaté úložisko informácií o chemických prvkoch, ich vlastnostiach a vlastnostiach ich zlúčenín, o zákonitostiach zmien týchto vlastností, o metódach získavania látok, ako aj o ich prítomnosti v prírode. Napríklad je známe, že s nárastom poradového čísla chemického prvku v periódach sa polomery atómov zmenšujú a v skupinách sa zväčšujú.
Vzhľadom na tieto vzory usporiadajte nasledujúce prvky v poradí podľa rastúcich atómových polomerov: N, C, Al, Si. Zapíšte si označenia prvkov v správnom poradí.
Odpoveď: _____________________________
N → C → Si → Al
4. V tabuľke nižšie sú uvedené charakteristické vlastnosti látok, ktoré majú molekulárnu a iónovú štruktúru.
Pomocou týchto informácií určite, akú štruktúru majú látky dusík N2 a kuchynská soľ NaCl. Svoju odpoveď napíšte na určené miesto:
1) dusík N2 _________________________________________________________________
2) kuchynská soľ NaCl __________________________________________________
dusík N2 - molekulárna štruktúra;
kuchynská soľ NaCl - iónová štruktúra
5. Komplexné anorganické látky môžu byť podmienene rozdelené, to znamená klasifikované, do štyroch skupín, ako je znázornené na diagrame. V tejto schéme zadajte pre každú zo štyroch skupín chýbajúce názvy skupín alebo chemické vzorce látok (jeden príklad vzorcov) patriacich do tejto skupiny.

Zaznamenávajú sa názvy skupín: zásady, soli;
zapisujú sa vzorce látok zodpovedajúcich skupín
CaO, zásady, HCl, soli
Prečítajte si nasledujúci text a vykonajte úlohy 6-8.
V potravinárstve sa používa potravinárska prídavná látka E526, čo je hydroxid vápenatý Ca (OH) 2. Uplatnenie nachádza pri výrobe: ovocných štiav, detskej výživy, nakladaných uhoriek, kuchynskej soli, cukroviniek a sladkostí.
Výroba hydroxidu vápenatého v priemyselnom meradle je možná zmiešaním oxidu vápenatého s vodou, tento proces sa nazýva kalenie.
Hydroxid vápenatý sa široko používa pri výrobe stavebných materiálov, ako sú malty, omietky a sadrové malty. Je to kvôli jeho schopnostiam interagovať s oxidom uhličitým CO2 obsiahnuté vo vzduchu. Rovnaká vlastnosť roztoku hydroxidu vápenatého sa používa na meranie množstva oxidu uhličitého vo vzduchu.
Užitočnou vlastnosťou hydroxidu vápenatého je jeho schopnosť pôsobiť ako flokulant, ktorý čistí odpadovú vodu od suspendovaných a koloidných častíc (vrátane solí železa). Používa sa aj na zvýšenie pH vody, keďže prírodná voda obsahuje látky (napr. kyseliny), čo spôsobuje koróziu vo vodovodnom potrubí.
1. Napíšte molekulovú rovnicu reakcie za vzniku hydroxidu vápenatého, ktorý
uvedené v texte.
2. Vysvetlite, prečo sa tento proces nazýva kalenie.
Odpoveď: ___________________________________________________________________________
________________________________________________________________________________
1) CaO + H20 \u003d Ca (OH) 2
2) Pri interakcii oxidu vápenatého s vodou vzniká veľké množstvo
množstvo tepla, takže voda vrie a syčí, ako keby narážala na žeravé uhlie, keď sa oheň hasí vodou (alebo „hasenie tohto procesu sa nazýva, pretože v dôsledku toho vzniká hasené vápno“)
1. Napíšte molekulovú rovnicu pre reakciu medzi hydroxidom vápenatým a oxidom uhličitým
plyn, ktorý bol v texte uvedený.
Odpoveď: ___________________________________________________________________________
2. Vysvetlite, aké vlastnosti tejto reakcie umožňujú jej zisťovanie
oxid uhličitý vo vzduchu.
Odpoveď: ___________________________________________________________________________
________________________________________________________________________________
________________________________________________________________________________
1) Ca(OH)2 + C02 = CaC03↓ + H20
2) V dôsledku tejto reakcie sa vytvorí nerozpustná látka - uhličitan vápenatý, pozoruje sa zakalenie pôvodného roztoku, čo umožňuje posúdiť prítomnosť oxidu uhličitého vo vzduchu (kvalitatívne
reakcia na CO2)
1. Zostavte skrátenú iónovú rovnicu reakcie uvedenej v texte medzi
hydroxid vápenatý a kyselina chlorovodíková.
Odpoveď: ___________________________________________________________________________
2. Vysvetlite, prečo sa táto reakcia používa na zvýšenie pH vody.
Odpoveď: ___________________________________________________________________________
________________________________________________________________________________
________________________________________________________________________________
1) OH - + H+ = H20 (Ca(OH)2+ 2HCl = CaCl2 + 2H20)
2) Prítomnosť kyselín v prírodnej vode spôsobuje nízke hodnoty pH tejto vody. Hydroxid vápenatý neutralizuje kyseliny a hodnoty pH stúpajú
Stupnica pH existuje od 0 do 14. od 0-6 - kyslé prostredie, 7 - neutrálne prostredie, 8-14 - alkalické prostredie
9. Je uvedená schéma redoxnej reakcie.
H2S + Fe203 → FeS + S + H20
1. Urobte elektronickú rovnováhu tejto reakcie.
Odpoveď: ___________________________________________________________________________
2. Špecifikujte oxidačné činidlo a redukčné činidlo.
Odpoveď: ___________________________________________________________________________
3. Usporiadajte koeficienty v rovnici reakcie.
Odpoveď: ___________________________________________________________________________
1) Zostavená elektronická váha:
| 2Fe +3 + 2ē → 2Fe +2 | 2 | 1 | |
| 2 | |||
| S -2 - 2ē → S 0 | 2 | 1 |
2) Uvádza sa, že síra v oxidačnom stave –2 (alebo H 2 S) je redukčné činidlo a železo v oxidačnom stave +3 (alebo Fe 2 O 3) je oxidačné činidlo;
3) Reakčná rovnica sa skladá:
3H2S + Fe2O3 \u003d 2FeS + S + 3H20
10. Schéma transformácií je uvedená:
Fe → FeCl 2 → Fe(NO 3) 2 → Fe(OH) 2
Napíšte rovnice molekulárnej reakcie, ktoré možno použiť na uskutočnenie
naznačené transformácie.
1) _________________________________________________________________________
2) _________________________________________________________________________
3) _________________________________________________________________________
Reakčné rovnice zodpovedajúce transformačnej schéme sú napísané:
1) Fe + 2HCl = FeCl2 + H2
2) FeCl2 + 2AgN03 \u003d Fe (N03)2 + 2AgCl
3) Fe(N03)2 + 2KOH = Fe(OH)2 + 2KN03
(Iné, ktoré nie sú v rozpore s podmienkou stanovenia rovnice, sú povolené
reakcie.)
11. Vytvorte súlad medzi vzorcom organickej hmoty a triedou / skupinou do ktorej táto látka patrí: pre každú pozíciu označenú písmenom vyberte zodpovedajúcu polohu označenú číslom.
Zapíšte do tabuľky vybrané čísla pod príslušné písmená.
odpoveď:
| ALE | B | AT |
- C3H8 - CnH2n + 2 - alkán
- C3H6 – CnH2n- alkén
- C2H6O - CnH2n + 2O- alkohol
12. Do navrhovaných schém chemických reakcií vložte vzorce chýbajúcich látok a usporiadajte koeficienty.
1) C2H6 + …………………..… → C2H5Cl + HCl
2) C3H6 + …………………..... → CO2 + H20
1) C2H6 + Cl2 -> C2H5CI + HCl
2) 2C3H6 + 902 → 6CO2 + 6H20
(Je možný zlomkový kurz.)
13. Propán horí s nízkymi emisiami toxických látok do atmosféry, preto sa používa ako zdroj energie v mnohých oblastiach, napríklad v plynových zapaľovačoch a na vykurovanie vidieckych domov.
Aký objem oxidu uhličitého (N.O.) vznikne pri úplnom spálení 4,4 g propánu?
Napíšte podrobné riešenie problému.
Odpoveď: ___________________________________________________________________________
________________________________________________________________________________
________________________________________________________________________________
1) Bola zostavená rovnica pre reakciu spaľovania propánu:
C3H8 + 502 -> 3C02 + 4H20
2) n (C3H8) \u003d 4,4 / 44 \u003d 0,1 mol
n (CO 2) \u003d 3n (C3H8) \u003d 0,3 mol
3) V (O 2) \u003d 0,3 22,4 \u003d 6,72 l
14. Izopropylalkohol sa používa ako univerzálne rozpúšťadlo: je súčasťou domácich chemikálií, parfumov a kozmetiky, kvapalín do ostrekovačov automobilov. V súlade s nižšie uvedenou schémou zostavte rovnice pre reakcie na získanie tohto alkoholu. Pri písaní reakčných rovníc používajte štruktúrne vzorce organických látok.

1) _______________________________________________________
2) _______________________________________________________
3) _______________________________________________________
Reakčné rovnice sú napísané podľa schémy:

(Povolené sú aj iné, ktoré nie sú v rozpore s podmienkou stanovenia reakčnej rovnice.)
15. Fyziologický roztok v medicíne sa nazýva 0,9% roztok chloridu sodného vo vode. Vypočítajte hmotnosť chloridu sodného a hmotnosť vody potrebnej na prípravu 500 g fyziologického roztoku. Napíšte podrobné riešenie problému.
Odpoveď: ___________________________________________________________________________
________________________________________________________________________________
________________________________________________________________________________
1) m(NaCI) = 4,5 g
2) m(voda) = 495,5 g
m(r-ra) = 500 g m(soľ) = x
x/500 * 100 %= 0,9 %
m (soli) = 500* (0,9/100) = 4,5 g
© 2017 Federálna služba pre dohľad vo vzdelávaní a vede Ruskej federácie