Електролитите са вещества, чиито стопилки или разтвори провеждат електричество. Електролитите включват киселини, основи и повечето соли.
Дисоциация на електролити
Електролитите са вещества с йонни или силно полярни ковалентни връзки. Първите съществуват под формата на йони дори преди да бъдат прехвърлени в разтворено или разтопено състояние. Електролитите включват соли, основи, киселини.

Ориз. 1. Таблица разликата между електролити и неелектролити.
Разграничаване на силни и слаби електролити. Силните електролити, когато се разтварят във вода, напълно се дисоциират на йони. Те включват: почти всички разтворими соли, много неорганични киселини (например H 2 SO 4 , HNO 3 , HCl), хидроксиди на алкални и алкалоземни метали. Слабите електролити, когато се разтварят във вода, леко се дисоциират в йони. Те включват почти всички органични киселини, някои неорганични киселини (например H 2 CO 3), много хидроксиди (с изключение на хидроксиди на алкални и алкалоземни метали).

Ориз. 2. Таблица на силните и слабите електролити.
Водата също е слаб електролит.
Подобно на други химични реакции, електролитната дисоциация в разтворите се записва като уравнения на дисоциация. В същото време за силни електролити процесът се счита за необратим, а за електролити със средна сила и слаби като обратим.
киселини- Това са електролити, чиято дисоциация във водни разтвори протича с образуването на водородни йони като катиони. Многоосновните киселини се дисоциират на етапи. Всяка следваща стъпка протича с все повече и повече трудности, тъй като получените йони на киселинните остатъци са по-слаби електролити.
Основи- електролити, които се дисоциират във воден разтвор с образуването на хидроксиден йон OH- като анион. Образуването на хидроксиден йон е обща характеристика на основите и определя общите свойства на силните основи: алкален характер, горчив вкус, сапуненост на допир, реакция към индикатор, неутрализиране на киселини и др.
Алкални, дори слабо разтворими (например бариев хидроксид Ba (OH) 2) се дисоциират напълно, например:
Ba (OH) 2 \u003d Ba 2 + 2OH-
сол- това са електролити, които се дисоциират във воден разтвор с образуването на метален катион и киселинен остатък. Солите не се дисоциират на стъпки, а напълно:
Ca (NO 3) 2 \u003d Ca 2 + + 2NO 3 -
Теория на електролитната дисоциация
електролити- вещества, които претърпяват електролитна дисоциация в разтвори или се стопяват и провеждат електрически ток поради движението на йони.
Електролитната дисоциация е разграждането на електролитите до йони, когато се разтварят във вода.
Теорията на електролитната дисоциация (S. Arrhenius, 1887) в съвременния смисъл включва следните положения:
- Електролитите, когато се разтварят във вода, се разлагат (дисоциират) на йони – положителни (катиони) и отрицателни (аниони). Йонизацията протича най-лесно за съединения с йонна връзка (соли, алкали), които при разтваряне (ендотермичен процес на разрушаване на кристалната решетка) образуват хидратирани йони.

Ориз. 3. Схема на електролитна дисоциация на солта.
Хидратирането на йони е екзотермичен процес. Съотношението на енергийните разходи и печалбите определя възможността за йонизация в разтвора. Когато вещество с полярна ковалентна връзка (например хлороводород HCl) се разтвори, водните диполи се ориентират към съответните полюси на разтворената молекула, поляризират връзката и я превръщат в йонна, последвано от хидратиране на йоните. Този процес е обратим и може да протече изцяло или частично.
- хидратираните йони са стабилни и се движат произволно в разтвора. Под действието на електрически ток движението придобива насочен характер: катиони се движат към отрицателния пояс (катод), а аниони - към положителния пояс (анод).
- дисоциацията (йонизацията) е обратим процес. Пълнотата на йонизацията зависи от естеството на електролита (алкалните соли се дисоциират почти напълно), неговата концентрация (йонизацията става по-трудна с увеличаване на концентрацията), температура (увеличаването на температурата насърчава дисоциацията), естеството на разтворителя (йонизация се среща само в полярен разтворител, по-специално във вода).
- (Гръцки). Течно тяло, разложено от електрически (галваничен) ток. Речник на чужди думи, включени в руския език. Чудинов А.Н., 1910 г. ЕЛЕКТРОЛИТ Течност, подложена на разлагане от галваничен ток. Речник на чужди думи на руския език
електролит- a, m. електролит m. електро + гр. lytos е разградим. специалист. Химично вещество (в стопилка или разтвор), което може да се разложи на съставните си части при преминаване на електрически ток през него. електролит на акумулатора. БАСС 1. Хвърляне ... ... Исторически речник на галицизмите на руския език
електролит- Разтвор, в който при преминаване на електрически ток през него настъпва разлагане на вещество, което води до появата на електрически ток. Електролитът е в основата на акумулаторите и батериите. [Хипертекстов енциклопедичен речник на ... ... Наръчник за технически преводач
ЕЛЕКТРОЛИТ- ЕЛЕКТРОЛИТ, разтвор или разтопена сол, способни да провеждат електричество и използвани за ЕЛЕКТРОЛИЗА (по време на която се разлага). Токът в електролитите се провежда от заредени частици ЙОНИ, а не от електрони. Например в олово ... ... Научно-технически енциклопедичен речник
ЕЛЕКТРОЛИТ- ЕЛЕКТРОЛИТ, електролит, съпруг. (от думата електрически и гръцки lytos разтворен) (физически). Разтвор на вещество, което може да бъде разбито на съставните си части чрез електролиза. Тълковен речник на Ушаков. Д.Н. Ушаков. 1935 1940... Тълковен речник на Ушаков
електролит- съществително, брой синоними: 1 католит (1) ASIS Synonym Dictionary. В.Н. Тришин. 2013 ... Синонимен речник
Електролит- Електролитите са вещества, разтвори и сплави, които с други вещества електролитно провеждат галваничен ток. За признак на електролитна проводимост, за разлика от металната, трябва да се счита способността да се наблюдава химично ... ... Енциклопедия на Брокхаус и Ефрон
електролит- - вещество, чийто воден разтвор или стопилка провежда електрически ток. Обща химия: учебник / A. V. Zholnin ... Химически термини
ЕЛЕКТРОЛИТ- вещество, чийто воден разтвор или стопилка провежда електрически ток (виж), получен от електролит (виж). Това Е., наричано още (виж) втори вид, се различава от металите (проводници от първия вид), в които прехвърлянето ... Голяма политехническа енциклопедия
Книги
- , Горичев Игор Георгиевич , Атанасян Т. К. , Якушева Е. А. Категория: Разни Издател: Прометей, Производител: Prometheus, Купете за 483 UAH (само за Украйна)
- Неорганична химия. Част I. Повърхностни явления на интерфейса оксид/електролит в киселинна среда, Горичев Игор Георгиевич, Атанасян Т.К., Якушева Е.А. електрически двоен слой върху... Категория: Химически науки Издател: Прометей, Купете за 377 рубли
- Неорганична химия, част I Повърхностни явления на границата оксид-електролит в киселинна среда Урок,
В раздела на въпроса Какви вещества са електролити? дадено от автора Олга Дубровинанай-добрият отговор е Веществата, които се разлагат на йони в разтвори или се стопяват и следователно провеждат електрически ток, се наричат електролити. Веществата, които не се разлагат на йони при едни и същи условия и не провеждат електрически ток, се наричат неелектролити. Силните електролити са вещества, които при разтваряне във вода почти напълно се разлагат на йони. По правило силните електролити включват вещества с йонни или силно полярни връзки: всички силно разтворими соли, силни киселини (HCl, HBr, HI, HClO4, H2SO4, HNO3) и силни основи (LiOH, NaOH, KOH, RbOH, CsOH, Ba (OH) 2, Sr (OH) 2, Ca (OH) 2).В силен електролитен разтвор разтвореното вещество е главно под формата на йони (катиони и аниони); недисоциирани молекули практически липсват Слаби електролити Вещества, които частично се дисоциират на йони. Разтворите на слаби електролити, заедно с йони, съдържат недисоциирани молекули. Слабите електролити не могат да дадат висока концентрация на йони в разтвора.Слабите електролити включват: 1) почти всички органични киселини (CH3COOH, C2H5COOH и др.); 2) някои неорганични киселини (H2CO3, H2S и др.); 3) почти всички лошо разтворими соли, основи и амониев хидроксид във вода (Ca3 (PO4) 2; Cu (OH) 2; Al (OH) 3; NH4OH); 4) вода. Те слабо (или почти не провеждат) електрически ток. СH3COOH « CH3COO - + H+Cu(OH)2 « + + OH- (първи етап)+ « Cu2+ + OH- (втори етап) H2CO3 « H+ + HCO- (първи етап) HCO3- « H+ + CO32- (втори етап)
Отговор от Просянка[гуру]
киселини, основи и някои соли
Отговор от европейски[гуру]
Да, киселини, соли и основи, но като цяло тези, които са в разтворено състояние, не го правят в чиста форма
Отговор от Адаптивност[гуру]
Всеки, който се дисоциира на йони във вода .. :-))
Отговор от Анел Садуакасова[новак]
ЕЛЕКТРОЛИТИ са разтвори на соли, киселини и основи, както и разтопени соли и метали. Електролитите са добри проводници на електрически ток.
Отговор от Оля Титова[новак]
всички силно разтворими соли, силни киселини (HCl, HBr, HI, HClO4, H2SO4, HNO3) и силни основи (LiOH, NaOH, KOH, RbOH, CsOH, Ba(OH)2,Sr(OH)2,Ca(OH) 2).
Отговор от Йохлана[майстор]
Електролитите включват: киселини, соли, основи
Отговор от Линг Куон[новак]
С йонен и ковалентен полярен тип химична връзка.
Електролитите като химикали са познати от древни времена. Въпреки това, те са завладяли повечето от областите си на приложение сравнително наскоро. Ще обсъдим най-приоритетните области за индустрията да използва тези вещества и ще разберем какви са последните и как се различават един от друг. Но нека започнем с екскурзия в историята.
История
Най-старите известни електролити са соли и киселини, открити в древния свят. Въпреки това, идеите за структурата и свойствата на електролитите са се развили с течение на времето. Теориите за тези процеси се развиват от 1880-те години, когато са направени редица открития, свързани с теориите за свойствата на електролитите. Има няколко качествени скока в теориите, описващи механизмите на взаимодействие на електролитите с водата (в края на краищата само в разтвор те придобиват свойствата, поради които се използват в промишлеността).
Сега ще анализираме подробно няколко теории, които са оказали най-голямо влияние върху развитието на представите за електролитите и техните свойства. И нека започнем с най-често срещаната и проста теория, която всеки от нас е преминал в училище.
Теория на Арениус за електролитната дисоциация
през 1887 г. шведският химик и Вилхелм Оствалд създават теорията за електролитната дисоциация. И тук обаче не всичко е толкова просто. Самият Арениус е привърженик на така наречената физическа теория на разтворите, която не отчита взаимодействието на съставните вещества с вода и твърди, че в разтвора има свободни заредени частици (йони). Между другото, от такива позиции днес в училище се разглежда електролитната дисоциация.
Нека поговорим какво дава тази теория и как ни обяснява механизма на взаимодействие на веществата с водата. Както всеки друг, тя има няколко постулата, които използва:
1. При взаимодействие с вода веществото се разлага на йони (положителен - катион и отрицателен - анион). Тези частици претърпяват хидратация: те привличат водни молекули, които, между другото, са положително заредени от едната страна и отрицателно заредени от другата (образуват дипол), в резултат на което се образуват във водни комплекси (солвати).
2. Процесът на дисоциация е обратим - тоест, ако веществото се е разпаднало на йони, то под въздействието на каквито и да е фактори може отново да се превърне в първоначалното.
3. Ако свържете електроди към разтвора и включите тока, тогава катионите ще започнат да се движат към отрицателния електрод - катода, а анионите към положително заредения - анода. Ето защо веществата, които са силно разтворими във вода, провеждат електричество по-добре от самата вода. По същата причина те се наричат електролити.
4. електролитът характеризира процента на вещество, което е претърпяло разтваряне. Този индикатор зависи от свойствата на разтворителя и самото разтворено вещество, от концентрацията на последния и от външната температура.
Тук всъщност са всички основни постулати на тази проста теория. Ще ги използваме в тази статия, за да опишем какво се случва в електролитен разтвор. Ще анализираме примери за тези съединения малко по-късно, но сега ще разгледаме друга теория.

Теория на киселината и основите на Люис
Според теорията на електролитната дисоциация киселината е вещество, в чийто разтвор присъства водороден катион, а основата е съединение, което се разлага до хидроксиден анион в разтвор. Има и друга теория, кръстена на известния химик Гилбърт Луис. Това ви позволява да разширите донякъде концепцията за киселина и основа. Според теорията на Луис, киселините са молекули на вещество, които имат свободни електронни орбитали и са в състояние да приемат електрон от друга молекула. Лесно е да се предположи, че основите ще бъдат такива частици, които са в състояние да дарят един или повече от своите електрони за "използването" на киселината. Тук е много интересно, че не само електролит, но и всяко вещество, дори неразтворимо във вода, може да бъде киселина или основа.

Протолитна теория на Брендстед-Лоури
През 1923 г., независимо един от друг, двама учени – Дж. Бронстед и Т. Лоури – предлагат теория, която сега се използва активно от учените за описване на химични процеси. Същността на тази теория е, че смисълът на дисоциацията се свежда до прехвърлянето на протон от киселина към основа. По този начин последният тук се разбира като акцептор на протони. Тогава киселината е техен донор. Теорията също така обяснява добре съществуването на вещества, които проявяват свойства както на киселини, така и на основи. Такива съединения се наричат амфотерни. В теорията на Бронстед-Лоури за тях се използва и терминът амфолити, докато киселините или основите обикновено се наричат протолити.
Стигнахме до следващата част от статията. Тук ще ви разкажем как силните и слабите електролити се различават един от друг и ще обсъдим влиянието на външни фактори върху техните свойства. И тогава ще преминем към описанието на тяхното практическо приложение.
Силни и слаби електролити
Всяко вещество взаимодейства с водата поотделно. Някои се разтварят добре в него (например готварска сол), докато някои не се разтварят изобщо (например тебешир). По този начин всички вещества се разделят на силни и слаби електролити. Последните са вещества, които взаимодействат лошо с вода и се утаяват на дъното на разтвора. Това означава, че те имат много ниска степен на дисоциация и висока енергия на връзката, което при нормални условия не позволява на молекулата да се разложи на съставните йони. Дисоциацията на слабите електролити става или много бавно, или с повишаване на температурата и концентрацията на това вещество в разтвора.
Да поговорим за силните електролити. Те включват всички разтворими соли, както и силни киселини и основи. Те лесно се разпадат на йони и е много трудно да се съберат при валежи. Токът в електролитите, между другото, се осъществява именно благодарение на йоните, съдържащи се в разтвора. Следователно силните електролити провеждат тока най-добре от всички. Примери за последните: силни киселини, основи, разтворими соли.

Фактори, влияещи върху поведението на електролитите
Сега нека да разберем как промяната във външната среда влияе върху концентрацията, пряко влияе върху степента на дисоциация на електролита. Освен това това съотношение може да бъде изразено математически. Законът, описващ тази връзка, се нарича закон за разреждане на Оствалд и се записва по следния начин: a = (K / c) 1/2. Тук a е степента на дисоциация (взета на фракции), K е константата на дисоциация, която е различна за всяко вещество, а c е концентрацията на електролита в разтвора. Чрез тази формула можете да научите много за веществото и неговото поведение в разтвор.
Но се отклоняваме от темата. Освен концентрацията, степента на дисоциация се влияе и от температурата на електролита. За повечето вещества увеличаването му повишава разтворимостта и реактивността. Това може да обясни възникването на някои реакции само при повишени температури. При нормални условия те вървят или много бавно, или в двете посоки (такъв процес се нарича обратим).
Ние анализирахме факторите, които определят поведението на система като електролитен разтвор. Сега нека преминем към практическото приложение на тези, без съмнение, много важни химикали.

Индустриална употреба
Разбира се, всеки е чувал думата "електролит" във връзка с батериите. Автомобилът използва оловно-киселинни акумулатори, електролитът в които е 40% сярна киселина. За да разберете защо изобщо е необходимо това вещество, си струва да разберете характеристиките на работата на батериите.
И така, какъв е принципът на работа на всяка батерия? При тях протича обратима реакция на преобразуване на едно вещество в друго, в резултат на което се освобождават електрони. При зареждане на батерията се осъществява взаимодействие на вещества, което не се получава при нормални условия. Това може да се представи като натрупване на електричество в дадено вещество в резултат на химическа реакция. Когато разреждането започне, започва обратната трансформация, която води системата до първоначалното състояние. Тези два процеса заедно съставляват един цикъл заряд-разряд.
Помислете за горния процес на конкретен пример - оловно-киселинна батерия. Както може да се досетите, този източник на ток се състои от елемент, съдържащ олово (както и оловен диоксид PbO 2) и киселина. Всяка батерия се състои от електроди и пространството между тях, запълнено само с електролит. Като последно, както вече разбрахме, в нашия пример се използва сярна киселина в концентрация от 40 процента. Катодът на такава батерия е направен от оловен диоксид, а анодът е от чисто олово. Всичко това е така, защото на тези два електрода протичат различни обратими реакции с участието на йони, в които киселината се е дисоциирала:
- PbO 2 + SO 4 2- + 4H + + 2e - \u003d PbSO 4 + 2H 2 O (реакция, протичаща при отрицателния електрод - катод).
- Pb + SO 4 2- - 2e - \u003d PbSO 4 (Реакция, протичаща при положителния електрод - анод).
Ако четем реакциите отляво надясно - получаваме процесите, които се случват при разреждане на батерията, а ако отдясно наляво - при зареждане. Всяка от тези реакции е различна, но механизмът на тяхното протичане обикновено се описва по един и същи начин: протичат два процеса, в единия от които електроните се „поглъщат“, а в другия, напротив, те „напускат“. Най-важното е броят на погълнатите електрони да е равен на броя на излъчените.
Всъщност, в допълнение към батериите, има много приложения на тези вещества. Като цяло електролитите, примери за които дадохме, са само зрънце от разнообразието от вещества, които се комбинират под този термин. Те ни заобикалят навсякъде, навсякъде. Вземете например човешкото тяло. Мислите ли, че тези вещества ги няма? Много грешите. Те са навсякъде в нас, а най-голямо количество са кръвните електролити. Те включват например железните йони, които са част от хемоглобина и спомагат за транспортирането на кислород до тъканите на нашето тяло. Кръвните електролити също играят ключова роля в регулирането на водно-солевия баланс и сърдечната функция. Тази функция се изпълнява от калиеви и натриеви йони (има дори процес, който протича в клетките, който се нарича калиево-натриева помпа).
Всички вещества, които можете да разтворите поне малко, са електролити. И няма такава индустрия и нашия живот с вас, където и да се прилагат. Това не са само батериите в автомобилите и акумулаторите. Това е всяко химическо и хранително производство, военни заводи, фабрики за облекло и така нататък.
Между другото, съставът на електролита е различен. Така че е възможно да се разграничат киселинен и алкален електролит. Те се различават фундаментално по своите свойства: както вече казахме, киселините са донори на протони, а алкалите са акцептори. Но с течение на времето съставът на електролита се променя поради загубата на част от веществото, концентрацията или намалява, или се увеличава (всичко зависи от това какво се губи, вода или електролит).
Срещаме ги всеки ден, но малко хора знаят точно определението на такъв термин като електролити. Анализирахме примери за конкретни вещества, така че нека да преминем към малко по-сложни понятия.

Физични свойства на електролитите
Сега за физиката. Най-важното нещо, което трябва да разберете, когато изучавате тази тема, е как токът се предава в електролити. Решаваща роля в това играят йоните. Тези заредени частици могат да прехвърлят заряд от една част на разтвора в друга. Така че анионите винаги са склонни към положителния електрод, а катионите - към отрицателния. По този начин, въздействайки върху разтвора с електрически ток, ние разделяме зарядите от различни страни на системата.
Такава физическа характеристика като плътност е много интересна. Много свойства на съединенията, които обсъждаме, зависят от него. И често се появява въпросът: "Как да повишим плътността на електролита?" Всъщност отговорът е прост: трябва да намалите съдържанието на вода в разтвора. Тъй като плътността на електролита се определя най-вече, тя зависи най-вече от концентрацията на последния. Има два начина за изпълнение на плана. Първият е съвсем прост: сварете електролита, съдържащ се в батерията. За да направите това, трябва да го заредите така, че температурата вътре да се повиши малко над сто градуса по Целзий. Ако този метод не помогне, не се притеснявайте, има още един: просто сменете стария електролит с нов. За да направите това, източете стария разтвор, почистете вътрешностите от остатъци от сярна киселина с дестилирана вода и след това изсипете нова порция. По правило висококачествените електролитни разтвори веднага имат желаната концентрация. След смяната можете да забравите за дълго време как да повишите плътността на електролита.
Съставът на електролита до голяма степен определя неговите свойства. Характеристики като електрическа проводимост и плътност, например, са силно зависими от природата на разтвореното вещество и неговата концентрация. Има отделен въпрос за това колко електролит може да има в батерията. Всъщност неговият обем е пряко свързан с декларираната мощност на продукта. Колкото повече сярна киселина е в батерията, толкова по-мощна е тя, т.е. толкова повече напрежение може да достави.

Къде е полезно?
Ако сте автомобилен ентусиаст или просто любители на колите, тогава вие сами разбирате всичко. Със сигурност дори знаете как да определите колко електролит има в батерията сега. И ако сте далеч от автомобилите, тогава познаването на свойствата на тези вещества, тяхното приложение и как те взаимодействат помежду си няма да бъде никак излишно. Като знаете това, няма да сте в загуба, ако бъдете помолени да кажете кой електролит е в батерията. Въпреки че дори и да не сте автомобилен ентусиаст, но имате кола, тогава познаването на устройството на акумулатора изобщо няма да е излишно и ще ви помогне при ремонт. Ще бъде много по-лесно и по-евтино да направите всичко сами, отколкото да отидете в автоцентъра.
И за да изучавате по-добре тази тема, препоръчваме да прочетете учебник по химия за училища и университети. Ако познавате добре тази наука и сте чели достатъчно учебници, „Химически източници на ток“ на Варипаев би бил най-добрият вариант. В него се очертава подробно цялата теория на работата на батериите, различните батерии и водородните клетки.
Заключение
Стигнахме до края. Нека обобщим. По-горе анализирахме всичко, свързано с такава концепция като електролити: примери, теория на структурата и свойствата, функции и приложения. Още веднъж си струва да кажем, че тези съединения са част от нашия живот, без които нашите тела и всички области на индустрията не биха могли да съществуват. Помните ли кръвните електролити? Благодарение на тях живеем. Ами нашите коли? С тези знания ще можем да отстраним всеки проблем, свързан с батерията, тъй като сега разбираме как да увеличим плътността на електролита в нея.
Невъзможно е да се каже всичко, а ние не сме си поставили такава цел. В крайна сметка това не е всичко, което може да се каже за тези невероятни вещества.
Кратка версия на материала на тема "Електролити и неелектролити". Позволява бързо да се ориентирате в темата, т.к. представени под формата на таблица с дефиниции и примери. Това ще помогне за систематизиране на знанията, подготовка за проверка и тестова работа.
Преглед на съдържанието на документа
"Ясличка "Електролити и неелектролити""
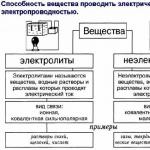
ВЕЩЕСТВА
| електролити | неелектролити |
| проводници от втори вид | (защото не образуват йони) |
| вещества с
киселини(HCl, HNO 3 , CH 3 COOH) , основания(KOH, NaOH, Ba (OH) 2), сол(KCl, NH4NO3, MgSO4), вода | вещества с
органични съединения прости вещества неметали(N 2, O 2, H 2) |
ЕЛЕКТРОЛИТИ
| силен | слаб |
| степента на дисоциация е по-малка от 3% |
|
| всички соли силни киселини силни основи(LiOH, KOH, NaOH, Ba(OH) 2)) | слабкиселини слаби основи |
| при разрежданеможе да стане силен. |
|
Степен на дисоциация (α)
α = N разпространение. / N общо
_____________________________________________________________________________________
Според способността за провеждане на ток във воден разтвор или стопилка
ВЕЩЕСТВА
| електролити | неелектролити |
| провеждат ток в разтвор или стопилка (тъй като има заредени частици - йони), проводници от втори вид | не провеждайте ток в разтвор или стопилка (защото не образуват йони) |
| вещества с йонна или силно полярна ковалентна връзка киселини(HCl, HNO 3 , CH 3 COOH) , основания(KOH, NaOH, Ba (OH) 2), сол(KCl, NH4NO3, MgSO4), вода | вещества с неполярна или слабо полярна ковалентна връзка органични съединения(въглеводороди, захароза, алкохоли), прости вещества неметали(N 2, O 2, H 2) |
ЕЛЕКТРОЛИТИ
| силен | слаб |
| степента на дисоциация е повече от 30% | степента на дисоциация е по-малка от 3% |
| всички соли– както разтворими, така и слабо разтворими; силни киселини(HCl, HBr, HI, HNO3, HClO3, HClO4, H2SO4 (разл.)); силни основи(LiOH, KOH, NaOH, Ba(OH) 2)) | слабкиселини(H2S, H2SO3, H2CO3, H2SiO3, CH3COOH); слаби основи- неразтворими метални хидроксиди и NH 4 OH. |
| Степента на дисоциация зависи от концентрацията на веществото в разтвора, така че някои слаби електролити при разрежданеможе да стане силен. |
|
Степен на дисоциация (α)е съотношението на броя на молекулите, разложени на йони (разпадане на N) към общия брой разтворени молекули (N общо)
α = N разпространение. / N общо