Elektrolity to substancje, których stopione lub roztwory przewodzą prąd elektryczny. Elektrolity obejmują kwasy, zasady i większość soli.
Dysocjacja elektrolitów
Elektrolity to substancje z jonowymi lub wysoce polarnymi wiązaniami kowalencyjnymi. Te pierwsze istnieją w postaci jonów jeszcze zanim zostaną przeniesione do stanu rozpuszczonego lub stopionego. Elektrolity obejmują sole, zasady, kwasy.

Ryż. 1. Tabela różnic między elektrolitami i nieelektrolitami.
Rozróżnij mocne i słabe elektrolity. Silne elektrolity po rozpuszczeniu w wodzie całkowicie dysocjują na jony. Należą do nich: prawie wszystkie rozpuszczalne sole, wiele kwasów nieorganicznych (np. H 2 SO 4 , HNO 3 , HCl), wodorotlenki metali alkalicznych i metali ziem alkalicznych. Słabe elektrolity po rozpuszczeniu w wodzie lekko dysocjują na jony. Należą do nich prawie wszystkie kwasy organiczne, niektóre kwasy nieorganiczne (na przykład H 2 CO 3), wiele wodorotlenków (z wyjątkiem wodorotlenków metali alkalicznych i metali ziem alkalicznych).

Ryż. 2. Tabela mocnych i słabych elektrolitów.
Woda jest również słabym elektrolitem.
Podobnie jak inne reakcje chemiczne, dysocjacja elektrolityczna w roztworach jest zapisywana jako równania dysocjacji. Jednocześnie dla mocnych elektrolitów proces ten uważa się za proces nieodwracalny, a dla elektrolitów o średniej i słabej mocy za proces odwracalny.
kwasy- Są to elektrolity, których dysocjacja w roztworach wodnych przebiega z utworzeniem jonów wodorowych w postaci kationów. Kwasy wielozasadowe dysocjują etapami. Każdy kolejny krok idzie z coraz większymi trudnościami, ponieważ powstające jony reszt kwasowych są słabszymi elektrolitami.
Podwaliny- elektrolity, które dysocjują w roztworze wodnym z utworzeniem jonu wodorotlenowego OH- jako anionu. Powstawanie jonu wodorotlenkowego jest wspólną cechą zasad i determinuje ogólne właściwości mocnych zasad: zasadowość, gorzki smak, mydlanie w dotyku, reakcję na wskaźnik, neutralizację kwasów itp.
Zasady, nawet słabo rozpuszczalne (np. wodorotlenek baru Ba (OH) 2) dysocjują całkowicie, np.:
Ba (OH) 2 \u003d Ba 2 + 2OH-
Sól- są to elektrolity, które dysocjują w roztworze wodnym z utworzeniem kationu metalu i pozostałości kwasowej. Sole nie dysocjują etapami, ale całkowicie:
Ca (NO 3) 2 \u003d Ca 2 + + 2NO 3 -
Teoria dysocjacji elektrolitycznej
elektrolity- substancje, które ulegają dysocjacji elektrolitycznej w roztworach lub topi się i przewodzą prąd elektryczny w wyniku ruchu jonów.
Dysocjacja elektrolityczna to rozkład elektrolitów na jony po rozpuszczeniu w wodzie.
Teoria dysocjacji elektrolitycznej (S. Arrhenius, 1887) we współczesnym znaczeniu zawiera następujące zapisy:
- Elektrolity po rozpuszczeniu w wodzie rozkładają się (dysocjują) na jony – dodatnie (kationy) i ujemne (aniony). Najłatwiej do jonizacji zachodzą związki z wiązaniem jonowym (sole, zasady), które po rozpuszczeniu (endotermiczny proces niszczenia sieci krystalicznej) tworzą jony uwodnione.

Ryż. 3. Schemat elektrolitycznej dysocjacji soli.
Hydratacja jonów jest procesem egzotermicznym. Stosunek kosztów i zysków energii określa możliwość jonizacji w roztworze. Gdy substancja z polarnym wiązaniem kowalencyjnym (na przykład chlorowodór HCl) zostanie rozpuszczona, dipole wody orientują się na odpowiednich biegunach rozpuszczonej cząsteczki, polaryzują wiązanie i przekształcają je w jonowe, po czym następuje uwodnienie jonów. Ten proces jest odwracalny i może przebiegać całkowicie lub częściowo.
- uwodnione jony są stabilne i poruszają się losowo w roztworze. Pod działaniem prądu elektrycznego ruch nabiera charakteru kierunkowego: kationy przemieszczają się w kierunku pasa ujemnego (katody), a aniony - w kierunku pasa dodatniego (anody).
- dysocjacja (jonizacja) jest procesem odwracalnym. Kompletność jonizacji zależy od charakteru elektrolitu (sole alkaliczne dysocjują prawie całkowicie), jego stężenia (jonizacja staje się trudniejsza wraz ze wzrostem stężenia), temperatury (wzrost temperatury sprzyja dysocjacji), charakteru rozpuszczalnika (jonizacja występuje tylko w rozpuszczalniku polarnym, w szczególności w wodzie).
- (Grecki). Ciało płynne rozkładane przez prąd elektryczny (galwaniczny). Słownik wyrazów obcych zawartych w języku rosyjskim. Chudinov A.N., 1910. ELEKTROLIT Ciecz ulegająca rozkładowi przez prąd galwaniczny ... ... Słownik wyrazów obcych języka rosyjskiego
elektrolit- a, m. elektrolit m. elektro + gr. Lytos ulega degradacji. specjalista. Substancja chemiczna (w stopie lub roztworze), która może rozkładać się na części składowe, gdy przepływa przez nią prąd elektryczny. elektrolit akumulatorowy. BAS 1. Rzucanie ... ... Słownik historyczny galicyzmów języka rosyjskiego
elektrolit- Rozwiązanie, w którym podczas przepływu prądu elektrycznego następuje rozkład substancji, co prowadzi do pojawienia się prądu elektrycznego. Elektrolit jest podstawą akumulatorów i baterii. [Słownik encyklopedyczny hipertekstu na ... ... Podręcznik tłumacza technicznego
ELEKTROLIT- ELEKTROLIT, roztwór lub stopiona sól zdolna do przewodzenia elektryczności i używana do ELEKTROLIZY (podczas której ulega rozkładowi). Prąd w elektrolitach jest prowadzony przez naładowane cząstki, jony, a nie elektrony. Na przykład w ołowiu ... ... Naukowy i techniczny słownik encyklopedyczny
ELEKTROLIT- ELEKTROLIT, elektrolit, mąż. (od słowa elektrycznego i greckiego lytos rozpuszczony) (fizyczny). Roztwór substancji rozkładającej się na części składowe przez elektrolizę. Słownik wyjaśniający Uszakowa. D.N. Uszakow. 1935 1940 ... Słownik wyjaśniający Uszakowa
elektrolit- rzeczownik, liczba synonimów: 1 katolit (1) Słownik synonimów ASIS. V.N. Triszyn. 2013 ... Słownik synonimów
Elektrolit- Elektrolity to substancje, roztwory i stopy, które wraz z innymi substancjami przewodzą elektrolitycznie prąd galwaniczny. Za znak przewodnictwa elektrolitycznego, w przeciwieństwie do metalicznego, należy uznać zdolność do obserwowania chemicznego ... ... Encyklopedia Brockhaus i Efron
elektrolit- - substancja, której roztwór wodny lub stopiony przewodzi prąd elektryczny. Chemia ogólna: podręcznik / A. V. Zholnin ... Terminy chemiczne
ELEKTROLIT- substancja, której wodny roztwór lub stop przewodzi prąd elektryczny (patrz), wynikający z elektrolizy (patrz). Ten E., zwany także (patrz) drugim rodzajem, różni się od metali (przewodników pierwszego rodzaju), w których transfer ... Wielka Encyklopedia Politechniczna
Książki
- , Gorichev Igor Georgievich , Atanasyan T. K . , Yakusheva E. A . Kategoria: Różne Wydawca: Prometheus, Producent: Prometeusz, Kup za 483 UAH (tylko Ukraina)
- Chemia nieorganiczna. Część I. Zjawiska powierzchniowe na granicy faz tlenek/elektrolit w środowisku kwaśnym, Gorichev Igor Georgievich, Atanasyan T. K., Yakusheva E. A. podwójna warstwa elektryczna na... Kategoria: Nauki chemiczne Wydawca: Prometheus, Kup za 377 zł
- Chemia nieorganiczna Część I Zjawiska powierzchniowe na granicy tlenkowo-elektrolitowej w środowisku kwaśnym Samouczek,
W części dotyczącej pytania Jakie substancje to elektrolity? podane przez autora Olga Dubrowina najlepszą odpowiedzią jest to, że substancje, które rozkładają się na jony w roztworach lub stopionych i dlatego przewodzą prąd elektryczny, nazywane są elektrolitami. Substancje, które nie rozkładają się na jony w tych samych warunkach i nie przewodzą prądu elektrycznego, nazywane są nieelektrolitami. Silne elektrolity to substancje, które po rozpuszczeniu w wodzie prawie całkowicie rozkładają się na jony. Do silnych elektrolitów z reguły zalicza się substancje z wiązaniami jonowymi lub silnie polarnymi: wszystkie wysoko rozpuszczalne sole, mocne kwasy (HCl, HBr, HI, HClO4, H2SO4, HNO3) oraz mocne zasady (LiOH, NaOH, KOH, RbOH, CsOH, Ba (OH) 2, Sr (OH) 2, Ca (OH) 2) W silnym roztworze elektrolitu substancja rozpuszczona ma głównie postać jonów (kationów i anionów); cząsteczki niezdysocjowane są praktycznie nieobecne Słabe elektrolity Substancje, które częściowo dysocjują na jony. Roztwory słabych elektrolitów wraz z jonami zawierają niezdysocjowane cząsteczki. Słabe elektrolity nie mogą dawać wysokiego stężenia jonów w roztworze. Do słabych elektrolitów należą: 1) prawie wszystkie kwasy organiczne (CH3COOH, C2H5COOH itp.); 2) niektóre kwasy nieorganiczne (H2CO3, H2S itp.); 3) prawie wszystkie słabo rozpuszczalne sole, zasady i wodorotlenek amonu w wodzie (Ca3 (PO4) 2; Cu (OH) 2; Al (OH) 3; NH4OH); 4) woda. Słabo (lub prawie nie przewodzą) prądu elektrycznego. СH3COOH « CH3COO - + H+Cu(OH)2 « + + OH- (pierwszy etap)+ « Cu2+ + OH- (drugi etap) H2CO3 « H+ + HCO- (pierwszy etap) HCO3- « H+ + CO32- (drugi etap)
Odpowiedz od Prosyanka[guru]
kwasy, zasady i niektóre sole
Odpowiedz od europejski[guru]
Tak, kwasy, sole i zasady, ale generalnie te, które w stanie rozpuszczonym nie prowadzą tak w czystej postaci
Odpowiedz od Zdolność adaptacji[guru]
Każdy, kto w wodzie dysocjuje na jony .. :-))
Odpowiedz od Anel Saduakasova[Nowicjusz]
ELEKTROLITY to roztwory soli, kwasów i zasad oraz stopionych soli i metali. Elektrolity są dobrymi przewodnikami prądu elektrycznego.
Odpowiedz od Olia Titova[Nowicjusz]
wszystkie wysoko rozpuszczalne sole, mocne kwasy (HCl, HBr, HI, HClO4, H2SO4, HNO3) oraz mocne zasady (LiOH, NaOH, KOH, RbOH, CsOH, Ba(OH)2,Sr(OH)2,Ca(OH) 2).
Odpowiedz od Johlan[mistrz]
Do elektrolitów należą: kwasy, sole, zasady
Odpowiedz od Ling Kwon[Nowicjusz]
Z jonowym i kowalencyjnym polarnym typem wiązania chemicznego.
Elektrolity jako chemikalia są znane od czasów starożytnych. Jednak stosunkowo niedawno podbili większość swoich obszarów zastosowań. Omówimy obszary o najwyższym priorytecie dla przemysłu w zakresie stosowania tych substancji i dowiemy się, czym one są i czym się od siebie różnią. Ale zacznijmy od wycieczki do historii.
Fabuła
Najstarsze znane elektrolity to sole i kwasy, odkryte w starożytnym świecie. Jednak pomysły dotyczące struktury i właściwości elektrolitów ewoluowały z biegiem czasu. Teorie tych procesów ewoluowały od lat 80. XIX wieku, kiedy dokonano szeregu odkryć związanych z teoriami właściwości elektrolitów. Dokonano kilku skoków jakościowych w teoriach opisujących mechanizmy oddziaływania elektrolitów z wodą (w końcu dopiero w roztworze uzyskują one właściwości, dzięki którym są wykorzystywane w przemyśle).
Teraz szczegółowo przeanalizujemy kilka teorii, które miały największy wpływ na rozwój idei dotyczących elektrolitów i ich właściwości. I zacznijmy od najpowszechniejszej i najprostszej teorii, którą każdy z nas zdał w szkole.
Teoria dysocjacji elektrolitycznej Arrheniusa
w 1887 szwedzki chemik i Wilhelm Ostwald stworzyli teorię dysocjacji elektrolitycznej. Jednak tutaj też nie wszystko jest takie proste. Sam Arrhenius był zwolennikiem tzw. fizycznej teorii roztworów, która nie uwzględniała oddziaływania substancji składowych z wodą i twierdziła, że w roztworze znajdują się swobodne cząstki (jony). Nawiasem mówiąc, to właśnie z takich pozycji rozważa się dziś w szkole dysocjację elektrolityczną.
Porozmawiajmy o tym, co daje ta teoria i jak wyjaśnia nam mechanizm interakcji substancji z wodą. Jak każda inna ma kilka postulatów, z których korzysta:
1. Podczas interakcji z wodą substancja rozkłada się na jony (dodatni - kation i ujemny - anion). Cząsteczki te ulegają uwodnieniu: przyciągają cząsteczki wody, które notabene są z jednej strony naładowane dodatnio, a z drugiej ujemnie (tworzą dipol), w wyniku czego tworzą się aquakompleksy (solwaty).
2. Proces dysocjacji jest odwracalny - to znaczy, jeśli substancja rozpadła się na jony, to pod wpływem jakichkolwiek czynników może ponownie przekształcić się w pierwotną.
3. Jeśli podłączysz elektrody do roztworu i włączysz prąd, to kationy zaczną przemieszczać się w kierunku elektrody ujemnej - katody, a aniony w kierunku dodatnio naładowanej - anody. Dlatego substancje dobrze rozpuszczalne w wodzie przewodzą elektryczność lepiej niż sama woda. Z tego samego powodu nazywane są elektrolitami.
4. elektrolit charakteryzuje procent substancji, która uległa rozpuszczeniu. Wskaźnik ten zależy od właściwości rozpuszczalnika i samej substancji rozpuszczonej, od stężenia tego ostatniego oraz od temperatury zewnętrznej.
Oto w rzeczywistości wszystkie główne postulaty tej prostej teorii. Wykorzystamy je w tym artykule, aby opisać, co dzieje się w roztworze elektrolitu. Nieco później przeanalizujemy przykłady tych związków, ale teraz rozważymy inną teorię.

Teoria kwasów i zasad Lewisa
Zgodnie z teorią dysocjacji elektrolitycznej kwas to substancja, w której występuje kation wodorowy, a zasada to związek, który w roztworze rozkłada się na anion wodorotlenkowy. Istnieje inna teoria nazwana na cześć słynnego chemika Gilberta Lewisa. Pozwala nieco rozszerzyć pojęcie kwasu i zasady. Zgodnie z teorią Lewisa kwasy są cząsteczkami substancji, które mają orbitale wolnych elektronów i są w stanie przyjąć elektron z innej cząsteczki. Łatwo się domyślić, że bazami będą takie cząstki, które będą w stanie oddać jeden lub więcej swoich elektronów do „użytkowania” kwasu. Bardzo interesujące jest tutaj to, że kwasem lub zasadą może być nie tylko elektrolit, ale także każda substancja, nawet nierozpuszczalna w wodzie.

Protolityczna teoria Brendsteda-Lowry'ego
W 1923 roku, niezależnie od siebie, dwóch naukowców - J. Bronsted i T. Lowry - zaproponowało teorię, która jest obecnie aktywnie wykorzystywana przez naukowców do opisu procesów chemicznych. Istotą tej teorii jest to, że znaczenie dysocjacji sprowadza się do przeniesienia protonu z kwasu na zasadę. Tak więc ten ostatni jest tutaj rozumiany jako akceptor protonów. Wtedy kwas jest ich dawcą. Teoria dobrze wyjaśnia również istnienie substancji wykazujących właściwości zarówno kwasów, jak i zasad. Takie związki nazywane są amfoterycznymi. W teorii Bronsteda-Lowry'ego określa się je również terminem amfolity, podczas gdy kwasy lub zasady są zwykle nazywane protolitami.
Doszliśmy do kolejnej części artykułu. Tutaj opowiemy, czym różnią się od siebie mocne i słabe elektrolity oraz omówimy wpływ czynników zewnętrznych na ich właściwości. A potem przejdziemy do opisu ich praktycznego zastosowania.
Silne i słabe elektrolity
Każda substancja oddziałuje z wodą indywidualnie. Niektóre dobrze się w nim rozpuszczają (na przykład sól kuchenna), a niektóre w ogóle się nie rozpuszczają (na przykład kreda). W ten sposób wszystkie substancje dzielą się na mocne i słabe elektrolity. Te ostatnie to substancje słabo oddziałujące z wodą i osadzające się na dnie roztworu. Oznacza to, że mają bardzo niski stopień dysocjacji i wysoką energię wiązania, co w normalnych warunkach nie pozwala na rozkład cząsteczki na jej składowe jony. Dysocjacja słabych elektrolitów zachodzi albo bardzo powoli, albo wraz ze wzrostem temperatury i stężenia tej substancji w roztworze.
Porozmawiajmy o mocnych elektrolitach. Należą do nich wszystkie rozpuszczalne sole, a także mocne kwasy i zasady. Łatwo rozpadają się na jony i bardzo trudno je zebrać podczas opadów atmosferycznych. Nawiasem mówiąc, prąd w elektrolitach odbywa się właśnie dzięki jonom zawartym w roztworze. Dlatego mocne elektrolity najlepiej przewodzą prąd. Przykłady tych ostatnich: mocne kwasy, zasady, rozpuszczalne sole.

Czynniki wpływające na zachowanie elektrolitów
Teraz zastanówmy się, jak zmiana środowiska zewnętrznego wpływa na stężenie bezpośrednio wpływa na stopień dysocjacji elektrolitu. Co więcej, stosunek ten można wyrazić matematycznie. Prawo opisujące to połączenie nazywa się prawem rozcieńczenia Ostwalda i jest zapisane w następujący sposób: a = (K / c) 1/2. Tutaj a jest stopniem dysocjacji (wzięty we frakcjach), K jest stałą dysocjacji, która jest różna dla każdej substancji, a c jest stężeniem elektrolitu w roztworze. Dzięki tej formule możesz się wiele dowiedzieć o substancji i jej zachowaniu w roztworze.
Ale odchodzimy od tematu. Oprócz stężenia na stopień dysocjacji wpływa również temperatura elektrolitu. W przypadku większości substancji jej zwiększenie zwiększa rozpuszczalność i reaktywność. To może tłumaczyć występowanie niektórych reakcji tylko w podwyższonych temperaturach. W normalnych warunkach przebiegają one albo bardzo wolno, albo w obu kierunkach (taki proces nazywa się odwracalnym).
Przeanalizowaliśmy czynniki, które determinują zachowanie systemu, takiego jak roztwór elektrolitu. Przejdźmy teraz do praktycznego zastosowania tych bez wątpienia bardzo ważnych chemikaliów.

Użytek przemysłowy
Oczywiście wszyscy słyszeli słowo „elektrolit” w odniesieniu do akumulatorów. W samochodzie zastosowano akumulatory kwasowo-ołowiowe, w których elektrolitem jest 40% kwas siarkowy. Aby zrozumieć, dlaczego ta substancja jest tam w ogóle potrzebna, warto zrozumieć cechy działania baterii.
Jaka jest więc zasada działania dowolnej baterii? W nich zachodzi odwracalna reakcja przemiany jednej substancji w drugą, w wyniku której uwalniane są elektrony. Podczas ładowania akumulatora dochodzi do interakcji substancji, która nie jest uzyskiwana w normalnych warunkach. Można to przedstawić jako akumulację elektryczności w substancji w wyniku reakcji chemicznej. Kiedy zaczyna się wyładowanie, rozpoczyna się transformacja odwrotna, prowadząca system do stanu początkowego. Te dwa procesy tworzą razem jeden cykl ładowania i rozładowania.
Rozważ powyższy proces na konkretnym przykładzie - akumulator kwasowo-ołowiowy. Jak można się domyślić, to źródło prądu składa się z pierwiastka zawierającego ołów (a także dwutlenek ołowiu PbO2) i kwas. Każda bateria składa się z elektrod i przestrzeni między nimi wypełnionej tylko elektrolitem. Jako ostatni, jak już się dowiedzieliśmy, w naszym przykładzie stosuje się kwas siarkowy w stężeniu 40 proc. Katoda takiego akumulatora wykonana jest z dwutlenku ołowiu, a anoda z czystego ołowiu. Wszystko to dlatego, że na tych dwóch elektrodach zachodzą różne odwracalne reakcje z udziałem jonów, na które zdysocjował kwas:
- PbO 2 + SO 4 2- + 4H + + 2e - \u003d PbSO 4 + 2H 2 O (reakcja zachodząca na elektrodzie ujemnej - katodzie).
- Pb + SO 4 2- - 2e - \u003d PbSO 4 (Reakcja zachodząca na elektrodzie dodatniej - anodzie).
Jeśli odczytamy reakcje od lewej do prawej – otrzymamy procesy, które zachodzą przy rozładowaniu akumulatora, a jeśli od prawej do lewej – podczas ładowania. W każdej z tych reakcji są różne, ale mechanizm ich występowania jest ogólnie opisany w ten sam sposób: zachodzą dwa procesy, z których w jednym elektrony są „pochłaniane”, a w drugim przeciwnie, „wychodzą”. Najważniejsze jest to, że liczba elektronów pochłoniętych jest równa liczbie elektronów wyemitowanych.
Właściwie poza bateriami istnieje wiele zastosowań tych substancji. Ogólnie rzecz biorąc, elektrolity, których przykłady podaliśmy, są tylko ziarnem różnorodności substancji, które łączy się pod tym terminem. Otaczają nas wszędzie, wszędzie. Weźmy na przykład ludzkie ciało. Czy uważasz, że tych substancji nie ma? Bardzo się mylisz. Są w nas wszędzie, a najwięcej elektrolitów we krwi. Należą do nich np. jony żelaza, które wchodzą w skład hemoglobiny i pomagają transportować tlen do tkanek naszego organizmu. Elektrolity krwi odgrywają również kluczową rolę w regulacji równowagi wodno-solnej i pracy serca. Funkcję tę pełnią jony potasu i sodu (w komórkach zachodzi nawet proces zwany pompą potasowo-sodową).
Wszelkie substancje, które możesz chociaż trochę rozpuścić, to elektrolity. I nie ma takiej branży i naszego życia z Wami, gdziekolwiek są one stosowane. To nie tylko akumulatory w samochodach i akumulatory. To każda produkcja chemiczna i spożywcza, zakłady wojskowe, zakłady odzieżowe i tak dalej.
Nawiasem mówiąc, skład elektrolitu jest inny. Można więc odróżnić elektrolit kwaśny i zasadowy. Zasadniczo różnią się one właściwościami: jak już powiedzieliśmy, kwasy są dawcami protonów, a zasady akceptorami. Ale z biegiem czasu skład elektrolitu zmienia się z powodu utraty części substancji, stężenie albo maleje, albo wzrasta (wszystko zależy od tego, co jest tracone, woda lub elektrolit).
Spotykamy się z nimi na co dzień, ale niewiele osób zna dokładnie definicję takiego terminu jak elektrolity. Przeanalizowaliśmy przykłady konkretnych substancji, przejdźmy więc do nieco bardziej złożonych pojęć.

Właściwości fizyczne elektrolitów
Teraz o fizyce. Najważniejszą rzeczą do zrozumienia podczas studiowania tego tematu jest sposób przesyłania prądu w elektrolitach. Jony odgrywają w tym decydującą rolę. Te naładowane cząstki mogą przenosić ładunek z jednej części roztworu do drugiej. Tak więc aniony zawsze mają tendencję do elektrody dodatniej, a kationy do elektrody ujemnej. W ten sposób, działając na rozwiązanie prądem elektrycznym, oddzielamy ładunki po różnych stronach układu.
Taka fizyczna cecha jak gęstość jest bardzo interesująca. Od tego zależy wiele właściwości omawianych przez nas związków. I często pojawia się pytanie: „Jak zwiększyć gęstość elektrolitu?” W rzeczywistości odpowiedź jest prosta: musisz obniżyć zawartość wody w roztworze. Ponieważ gęstość elektrolitu jest w większości określana, zależy głównie od stężenia tego ostatniego. Plan można zrealizować na dwa sposoby. Pierwsza jest dość prosta: zagotuj elektrolit zawarty w akumulatorze. Aby to zrobić, musisz go naładować, aby temperatura wewnątrz wzrosła nieco powyżej stu stopni Celsjusza. Jeśli ta metoda nie pomoże, nie martw się, jest jeszcze jedna: po prostu wymień stary elektrolit na nowy. Aby to zrobić, spuść stary roztwór, wyczyść wnętrze pozostałości kwasu siarkowego wodą destylowaną, a następnie wlej nową porcję. Z reguły wysokiej jakości roztwory elektrolitów natychmiast uzyskują pożądane stężenie. Po wymianie na długo można zapomnieć, jak podnieść gęstość elektrolitu.
Skład elektrolitu w dużej mierze determinuje jego właściwości. Charakterystyki, takie jak na przykład przewodność elektryczna i gęstość, w dużym stopniu zależą od natury substancji rozpuszczonej i jej stężenia. Osobne pytanie dotyczy tego, ile elektrolitu może znajdować się w akumulatorze. W rzeczywistości jego objętość jest bezpośrednio związana z deklarowaną mocą produktu. Im więcej kwasu siarkowego w akumulatorze, tym jest on mocniejszy, to znaczy tym większe napięcie może dostarczyć.

Gdzie jest to przydatne?
Jeśli jesteś entuzjastą samochodów lub po prostu lubisz samochody, sam wszystko rozumiesz. Na pewno wiesz nawet, jak określić, ile elektrolitu jest teraz w akumulatorze. A jeśli jesteś daleko od samochodów, znajomość właściwości tych substancji, ich zastosowania i wzajemnego oddziaływania nie będzie wcale zbyteczna. Wiedząc o tym, nie będziesz zagubiony, jeśli zostaniesz poproszony o określenie, który elektrolit jest w akumulatorze. Chociaż nawet jeśli nie jesteś entuzjastą samochodów, ale masz samochód, znajomość urządzenia akumulatorowego wcale nie będzie zbyteczna i pomoże ci w naprawach. O wiele łatwiej i taniej będzie zrobić wszystko samemu, niż udać się do auto centrum.
Aby lepiej poznać ten temat, zalecamy przeczytanie podręcznika chemii dla szkół i uniwersytetów. Jeśli dobrze znasz tę naukę i przeczytałeś wystarczająco dużo podręczników, najlepszą opcją byłyby „chemiczne źródła prądu” Warypajewa. Przedstawia szczegółowo całą teorię działania baterii, różnych baterii i ogniw wodorowych.
Wniosek
Doszliśmy do końca. Podsumujmy. Powyżej przeanalizowaliśmy wszystko, co dotyczy takiego pojęcia jak elektrolity: przykłady, teoria budowy i właściwości, funkcje i zastosowania. Jeszcze raz warto powiedzieć, że związki te są częścią naszego życia, bez której nasz organizm i wszystkie dziedziny przemysłu nie mogłyby istnieć. Pamiętasz elektrolity we krwi? Dzięki nim żyjemy. A co z naszymi samochodami? Dzięki tej wiedzy będziemy w stanie rozwiązać każdy problem związany z akumulatorem, ponieważ teraz rozumiemy, jak zwiększyć gęstość zawartego w nim elektrolitu.
Nie da się opowiedzieć wszystkiego, a my takiego celu nie postawiliśmy. W końcu to nie wszystko, co można powiedzieć o tych niesamowitych substancjach.
Krótka wersja materiału na temat „Elektrolity i nieelektrolity”. Pozwala szybko zorientować się w temacie, tk. przedstawione w formie tabeli z definicjami i przykładami. Pomoże usystematyzować wiedzę, przygotować do weryfikacji i pracy testowej.
Wyświetl zawartość dokumentu
„Łóżeczko „Elektrolity i nieelektrolity””
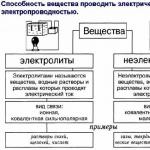
SUBSTANCJE
| elektrolity | nieelektrolity |
| przewodniki drugiego rodzaju | (ponieważ nie tworzą jonów) |
| substancje z
kwasy(HCl, HNO 3 , CH 3 COOH) , tereny(KOH, NaOH, Ba(OH) 2), Sól(KCl, NH 4 NO 3, MgSO 4), woda | substancje z
związki organiczne proste substancje niemetale(N 2, O 2, H 2) |
ELEKTROLITY
| mocny | słaby |
| stopień dysocjacji jest mniejszy niż 3% |
|
| wszystkie sole silne kwasy mocne podstawy(LiOH, KOH, NaOH, Ba(OH)) 2)) | słabykwasy słabe zasady |
| po rozcieńczeniu może stać się silny. |
|
Stopień dysocjacji (α)
α = Rozprzestrzenianie się N. / N łącznie
_____________________________________________________________________________________
Zgodnie ze zdolnością do przewodzenia prądu w roztworze wodnym lub stopie
SUBSTANCJE
| elektrolity | nieelektrolity |
| przewodzić prąd w roztworze lub stopić (ponieważ są naładowane cząstki - jony), przewodniki drugiego rodzaju | nie przewodzić prądu w roztworze ani nie topi się (ponieważ nie tworzą jonów) |
| substancje z wiązanie kowalencyjne jonowe lub wysoce polarne kwasy(HCl, HNO 3 , CH 3 COOH) , tereny(KOH, NaOH, Ba(OH) 2), Sól(KCl, NH 4 NO 3, MgSO 4), woda | substancje z niepolarne lub słabo polarne wiązanie kowalencyjne związki organiczne(węglowodory, sacharoza, alkohole), proste substancje niemetale(N 2, O 2, H 2) |
ELEKTROLITY
| mocny | słaby |
| stopień dysocjacji przekracza 30% | stopień dysocjacji jest mniejszy niż 3% |
| wszystkie sole– rozpuszczalne i słabo rozpuszczalne; silne kwasy(HCl, HBr, HI, HNO3, HCIO3, HCIO4, H2S04 (rozcieńczone)); mocne podstawy(LiOH, KOH, NaOH, Ba(OH)) 2)) | słabykwasy(H2S, H2SO3, H2CO3, H2SiO3, CH3COOH); słabe zasady- nierozpuszczalne wodorotlenki metali i NH 4 OH. |
| Stopień dysocjacji zależy od stężenia substancji w roztworze, więc niektóre słabe elektrolity po rozcieńczeniu może stać się silny. |
|
Stopień dysocjacji (α) to stosunek liczby cząsteczek rozłożonych na jony (rozpad N) do całkowitej liczby rozpuszczonych cząsteczek (N ogółem)
α = Rozprzestrzenianie się N. / N łącznie