Способы связи аминокислот в белковой молекуле
Основной структурной единицей белка являются α-аминокислоты.
Впервые, еще в 1888 г. А.Я.Данилевский установил, что аминокислоты в белковой молекуле соединяются -COOH и -NH 2 группами, образуя связи, в последующем названные пептидными связями. Пептидная связь образуется при взаимодействии карбоксильной группы первой аминокислоты с аминогруппой при α-углероде второй аминокислоты. При этом отщепляется молекула воды: например, из двух молекул аланина образуется дипептид аланил-аланин:
Соединение из двух аминокислот называют дипептидом, из трех – трипептидом и т.д. Связь – CO - NH - называется пептидной связью.
Если число аминокислотных остатков больше 10 , то называют полипептидом , свыше 50 – белками . Различают N -конец , где имеется свободная -NH 2 группа и С-конец пептида, где свободная -COOH группа аминокислоты. Кроме -COOH и -NH 2 групп, участвующих в образовании пептидной связи, аминокислоты содержат другие функциональные группы, размещенные в боковых ответвлениях белковой молекулы:
|
аспарагиновой и глутаминовой кислот |
|
|
лизина, оксилизина, |
|
|
|
гуанидиловая группа аргинина |
|
|
имидазольная группа гистидина |
|
серина и треонина |
|
|
|
фенольная группа тирозина |
|
сульфгидрильная группа цистеина |
|
|
тиоэфирная группа метионина |
|
|
бензольное кольцо фенилаланина |
|
|
алифатические цепи других аминокислот и т.д. |
Группу атомов в молекулах аминокислот, не принимающих участие в образовании пептидной связи, называют радикалами аминокислот. Различают аминокислоты с ионами-радикалами. К этой группе относятся 7 аминокислот с радикалами, обладающими отрицательными или положительными зарядами, в т.ч. аспарагиновая и глутаминовая кислоты с "-" зарядом, тирозин и цистеин также могут нести "-" заряд; лизин, аргинин и гистидин несут "+" заряд.
Полярные радикалы имеют серии и треонин (-ОН). Сюда же относятся аспарагин, глутамин. Третья группа аминокислот имеет неполярные алифатические или ароматические радикалы (аланин, валин, лейцин, изолейцин, метионин, фенилаланин, триптофан, пролин, оксипролин). Таким образом, в построении структуры белковой молекулы кроме образования пептидной связи имеют значение свойства радикалов аминокислот.
Пептиды - имеют Мм до 5000 дальтон (50 аминокислотных остатка), проходят через полупроницаемую мембрану. В природе известно свыше 200 пептидов, в том числе в организме животных и человека различают:
1.Пептиды-гормоны: вазопрессин, окситоцин, кортикотропин, глюкагон, кальцитонин, меланостимулирующий гормон.
2.Пептиды, принимающие участие в пищеварении, – гастрин, секретин – всего 12 пептидов.
З.Ангиотензин (сосудосуживающий), брадикинин.
4.Нейропептиды.
б.Низкомолекулярные (Мм 4 кДа) пептиды, обуславливающие устойчивость животных к разным инфекциям, обладающие широким спектром антимикробной активности.
Существуют пептиды, полученные путем синтеза. Например, синтетическая пептидная вакцина против ящура получена из 16-ти аминокислотных остатков. Небелковая часть фермента окислительно-восстановительных реакций является трипептидом: это глутатион (γ-глутамил-цистеинил-глицин):
Карнозин : β-аланил-гистидин и ансерин – метил-карнозин являются дипептидами: они усиливают мышечные сокращения, обладают антиоксидантными и мембраностабилизирующими свойствами. Пептиды из глицина и пролина влияют на свертывание крови, защищают слизистую оболочку желудка, влияют на головной мозг. Пептиды эндотелины регулируют тонус сосудов.
Дипептид аспартам (аспарагин + фенилаланин) получают методом генной инженерии. Он в 300 раз слаще сахара, его добавляют в напитки вместо сахара (кока-кола).
Различают 4 уровня структуры белковой молекулы.
Первичная структура белка – это последовательность (чередование) аминокислотных остатков в пептидной цепи. В образовании этой структуры участвуют пептидные связи, частично дисульфидные. Первичная структура закодирована в генах, она определяет остальные уровни организации белка. Впервые первичная структура белка инсулина была определена Сэнджером (1953 г.). Сейчас изучена первичная структура большого числа белков. Например, молекула инсулина состоит из двух частей: А-21, В-30 аминокислотных остатков.
Строение его можно представить в следующем виде:
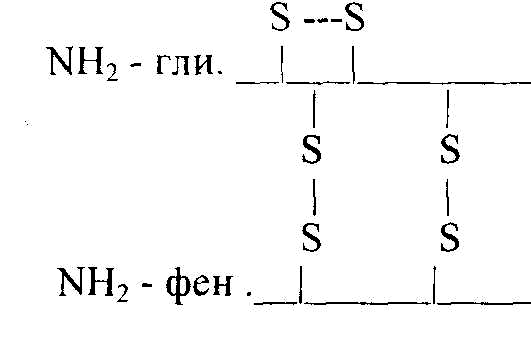 асп.
COOH
А цепь (21 аминокислотный остаток)
асп.
COOH
А цепь (21 аминокислотный остаток)
COOH В цепь (30 аминокислотных остатков)
Между цепями А и В и внутри А-цепи возникают дисульфидные связи. Первичная структура РНКазы из 124 аминокислотных остатков показана на рис. 2.2.
Исследование первичной структуры гемоглобина позволило установить, что серповидная анемия (рис.2.3.) – болезнь крови – обусловлена заменой лишь одной единственной аминокислоты в В цепи из 146 аминокислотных остатков.
Если в 6-положениии от N-конца находится валин вместо глутаминовой кислоты, то такой гемоглобин не выполняет функцию транспорта кислорода:
4 5 6 7 - положение аминокислот
Тре - про - глу - лиз - норма
Тре - про - вал - лиз - патология
Вторичная структура белка – это способ укладки полипептидной цепи в спиральную конфигурацию. Эта укладка происходит по программе, заложенной в первичной структуре.

Рис 2.2. Первичная структура РНКазы. Цветом выделены четыре дисульфидные связи.

Рис 2.3.Нормальные и серповидные эритроциты
Полинг и Кори установили, что глобулярные белки образуют α-спираль за счет водородных связей между радикалами аминокислот. Водородная связь возникает за счет карбонильной группы одного радикала и аминной группы другого радикала, между атомами кислорода и водорода, азота и водорода:
Карбонильная группа и NH-группа способны образовывать водородную связь между собой. Атомы кислорода и водорода пептидной группы занимают транс-положение, а вокруг - CH возможно свободное вращение:
![]()
В результате этого образование водородных связей обуславливает определенную форму пептида. Различают три типа вторичной структуры пептидных цепей: α-спираль, β-структура (складчатый слой), беспорядочный клубок.
α-спираль – это виток по часовой стрелке (рис.2.4).
Каждый виток содержит 3,6 аминокислот 5,4 А (1,5 А на 1 аминокислоту), через каждые 5 витков (18 аминокислотных остатков) структурная конфигурация повторяется, α-спиральную структуру имеют фибриллярные белки – кератины волос, шерсти, кожи, где -S-S- связи придают высокую прочность.
В складчатом слое (β-структура) пептидные цепи расположены параллельно друг другу в один слой, образуя фигуру гармошки или листа. Слой может быть образован двумя или большим числом пептидов.
Домены представляют собой надвторичную структуру (рис.2.5).
Водородная связь может образоваться не только между карбонильной группой (отрицательный заряд кислорода) и атомом водорода иминогруппы =NH другой полипептидной цепи, но и между двумя гидроксильными группами
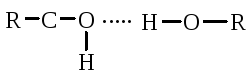
и гидроксильной группой серина и тирозина.
Вторичная структура коллагена. Количество коллагена в организме составляет 1/3 (сухожилия, связки, суставные капсулы и т.д.) от общего количества белков.
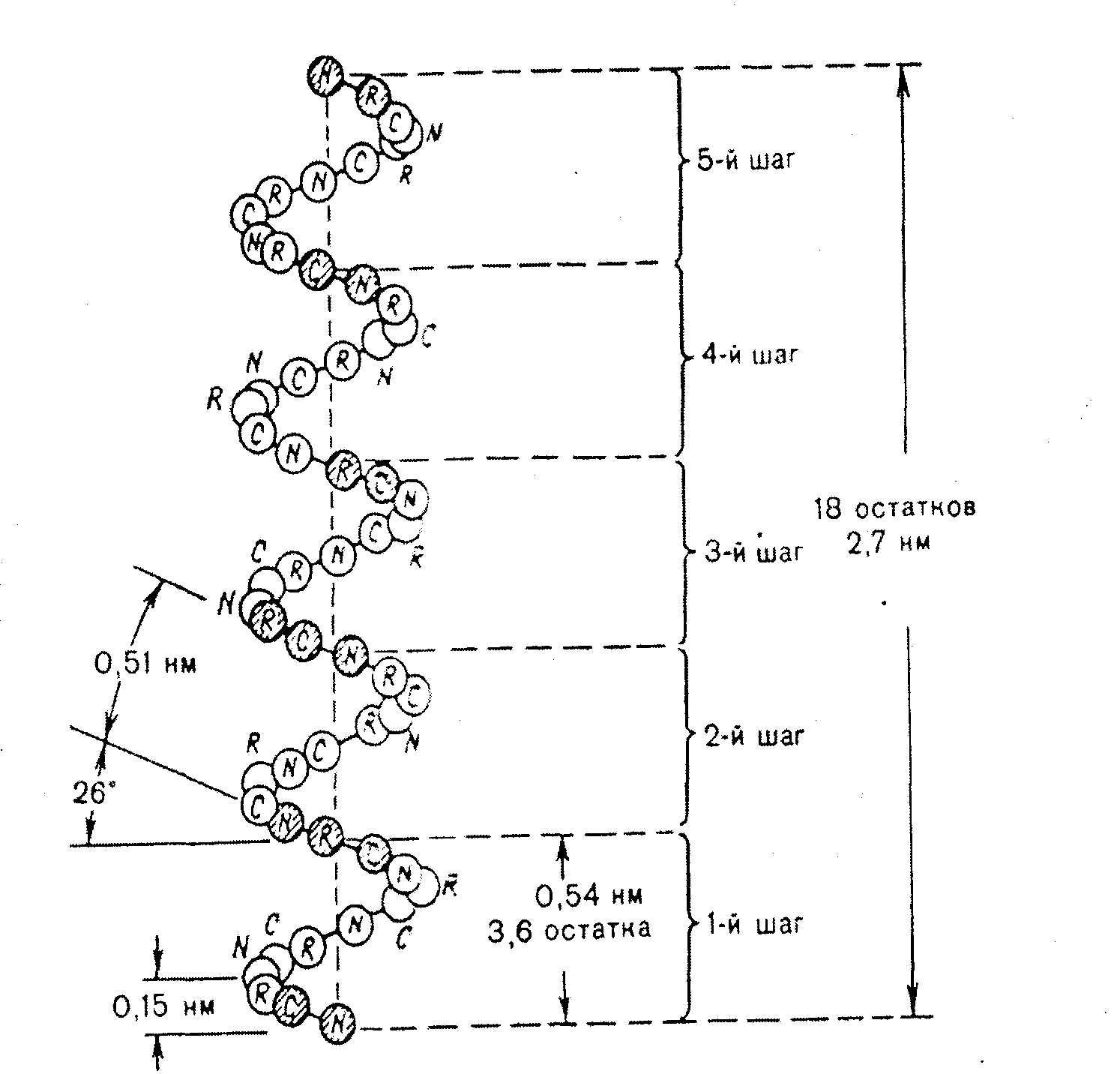
Рис. 2.4. Структура и параметры α-спирали.
В отличие от α- спирали кератинов коллаген плохо поддается растяжению. В составе коллагена много глицина - 1/3 из общего количества аминокислотных остатков, 1/4 и более составляют пролин и оксипролин. Эти аминокислоты нарушают способность полипептидных цепей образовывать α-спираль. В коллагене каждые 3 полипептидные цепи скручены и образуют тройную спираль.
Третичная структура белка. Это пространственная ориентация полипептидной спирали или способ укладки полипептидной цепи в определенном объеме.
Первый белок, третичная структура которого была выяснена англичанином Дж. Кендрью. Это миоглобин кашалота, молекулярная масса 16700 Да, содержит 153 аминокислотных остатка. Имеет одну полипептидную цепь. Полипептидная цепь представлена в виде изогнутой трубки, компактно уложенной вокруг гема (небелкового компонента, содержащего железо).
В настоящее время благодаря повышению эффективности рентгеноструктурного анализа расшифрована третичная структура многих белков.

Складчатый слой Домены
Рис. 2.5. Схема складчатого слоя и доменов.
Некоторые типы связей, стабилизирующих третичную структуру представлены на рис.2.6. пептид
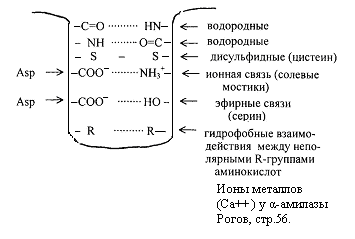
Рис.2.6. Связи, стабилизирующие вторичную и третичную структуру.
Третичная структура обеспечивается за счет пептидных и дисульфидных связей, но основную роль играют нековалентные связи – водородные, межмолекулярные силы Ван-дер-Ваальса-Лондона, гидрофобные взаимодействия и т.д.
Третичная структура белка возникает после завершения синтеза его на рибосомах, автоматически. Она определена первичной структурой – последовательностью аминокислотных остатков в полипептидной цепи. Третичная структура связана с биологической активностью белковой молекулы (каталитической, гормональной, антигенной и т.д.). Любые физико-химические воздействия, приводящие к разрыву водородных связей, а также других некоторых связей, и тем самым разрушающие нативную конформацию молекулы, сопровождаются частичной или полной потерей белком его биологических свойств (рис. 2.7.).
Четвертичная структура белка. Это укладка в пространстве отдельных полипептидных цепей, обладающих одинаковой (или разной) первичной, вторичной и третичной структурой, и формирование единого макромолекулярного образования. Каждая отдельная полипептидная цепь (протомер) чаще всего не обладает биологической активностью. Эту способность биологическая молекула приобретает при определенном способе пространственного объединения входящих в его состав протомеров, при этом образуется мультимер.
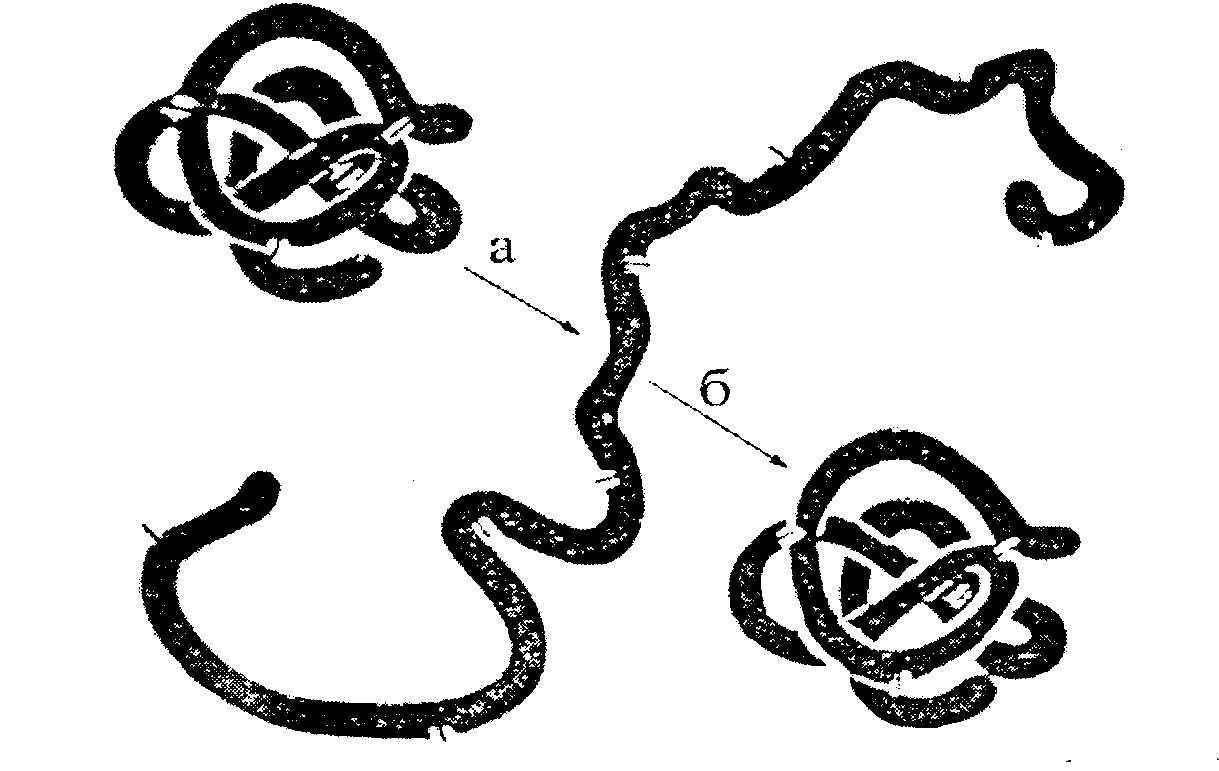
Рис.2.7. Денатурация и ренатурация рибонуклеазы (по Анфинсену).
а - развертывание (мочевина + меркаптоэтанол);
б - повторное свертывание
Например, молекула гемоглобина состоит из α- и β- субчастиц, каждая из которых состоит из двух полипептидных цепей. Каждая из 4-х полипептидов окружает группу гема, содержащего атом двухвалентного железа. При определенных условиях в присутствии солей, мочевины, изменении рН, молекул; гемоглобина обратимо диссоциирует на 2 α- и 2 β-цепи, что связано с разрывом водородных связей. После удаления солей, мочевины при изменения рН происходит автоматическое восстановление исходной молекулы (рис.2.8).
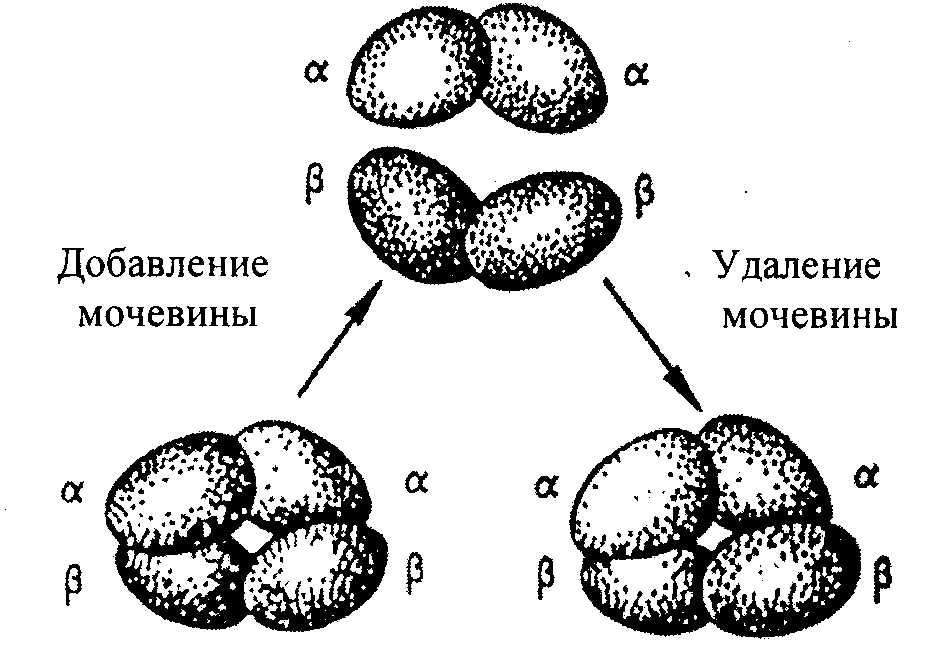
Рис.2.8. Обратимая диссоциация молекулы гемоглобина.
Белок вируса табачной мозаики имеет гигантскую молекулу с молекулярной массой около 40 х10 б Да, вирус состоит из 1 молекулы РНК и 2130 белковых субъединиц с молекулярной массой каждой 17500 Да. Вокруг РНК расположены белковые субъединицы, образующие спиральную структуру, которая имеет 130 витков. После добавления детергентов РНК может быть удалена; что самое удивительное - вирусная частица вновь может быть собрана автоматически после удаления детергентов. При этом восстанавливаются и биологические свойства вируса инфекционность, антигенная активность и т.д. (рис. 2.9.).
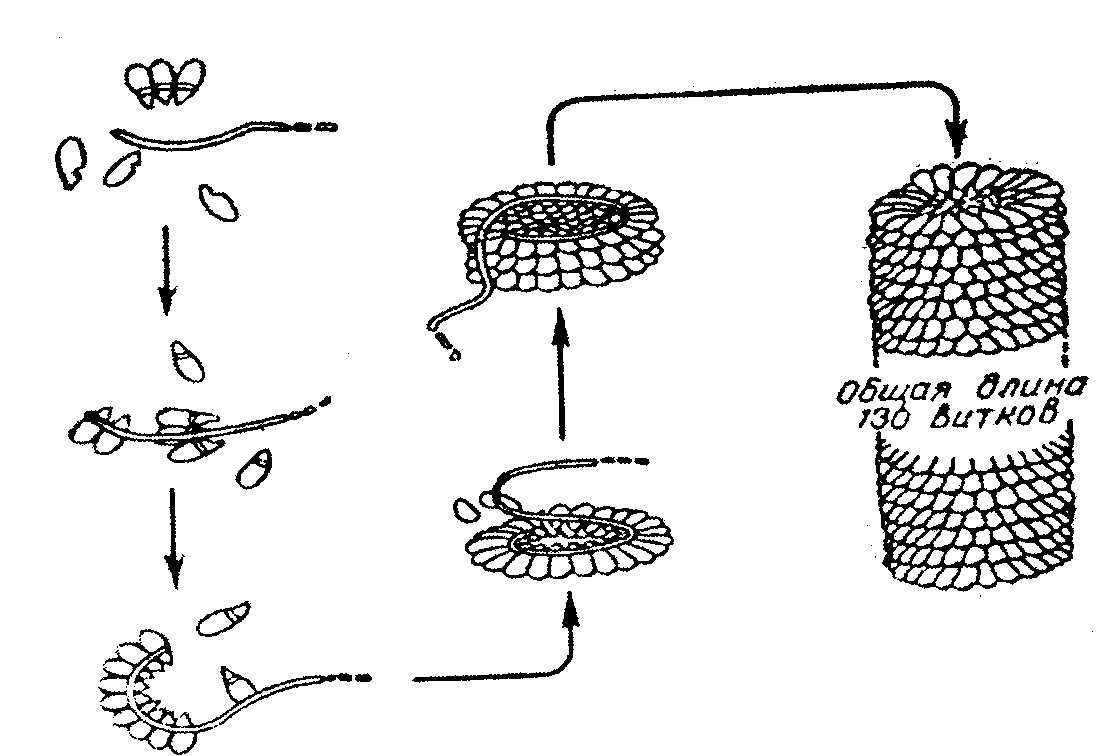
Рис. 2.9. Самосборка вируса табачной мозаики.
Микротрубочки имеются во всех клетках. Постоянно то распадаются, то вновь образуются, принимают участие во внутриклеточном транспорте веществ, в движении хромосом при делении клеток. Они построены из тубулина, который состоит из двух пептидов с Мм 111500 Да. Их можно выделить из клеток; под действием Mg 2+ образуются микротрубочки.
Рибосомы, клеточные мембраны также образованы из нескольких полипептидов (протомеров), которые взаимно укладываются и создают четвертичную структуру.
В середине 80-х годов было обнаружено, что в клетке существует особая категория белков, основной функцией которых является обеспечение правильного характера сворачивания полипептидных цепей в нативную структуру. Эти белки получили название "молекулярные шапероны". Они состоят из полипептидов, организованных в два семичленные кольца, лежащих одно под другим. В центре построенного таким образом цилиндра имеется полость – канал (диаметром 45 ангстрем), в котором происходит сворачивание полипептидной цепи. Кроме того, в укладке белковой молекулы участвуют ферменты фольдазы, катализирующие образование дисульфидных связей и изомерные превращения некоторых стабильных транс-пептидил-пролильных связей в цис-конфигурацию, необходимую для функциональной активности.
Здравствуйте, мои дорогие читатели. С вами я, Галина Баева, и сегодня мы поговорим о строении и функциях молекул белка.
Зачем он нужен, этот белок? Может, без него обойдемся?
Нет, не обойдемся. Бородатый основатель диалектического материализма Фридрих Энгельс сказал: жизнь – есть способ существования белковых тел. Иначе говоря, белок – это жизнь, нет белка – увы и ах. В норме белок составляет 50%, т.е. половину от сухой массы клетки, а от сухой массы тела человека они составляют от 45% .
Особенности строения белков позволяют им проявлять различные свойства, чем обусловлены их разнообразные биологические функции
Белки иначе называют протеинами, это одно и то же.
Чем занимаются белки в организме?
- Протеины являются теми кирпичиками, из которых сложен наш организм. Они являются структурными элементами клеточных мембран (липопротеины, гликопротеины), и внеклеточных структур. Коллаген образует сухожилия, он же отвечает за упругость кожи, кератин образует волосы и ногти.
- Протеины транспортируют необходимые элементы по организму. Гемоглобин переносит кислород от легких ко всем органам и тканям, а от них – уносит углекислый газ, белок альбумин переносит жирные кислоты, особые белки таскают холестерин. В составе клеточных мембран имеются белки, которые обеспечивают перенос некоторых веществ и ионов из клетки во внеклеточное пространство и обратно.
- Гормоны – особые вещества, регулирующие процессы обмена веществ – имеют белковую природу. Например, гормон инсулин загоняет сахар из плазмы крови в клетки
- Протеины защищают организма от чужеродных агентов. Гамма — глобулины обезвреживают микробов, интерфероны подавляют размножение вирусов. Фибрин останавливает кровотечения.
- Протеины обеспечивают сокращение двигательной мускулатуры и других сокращающихся тканей. Актин и миозин входят в состав мышц тела, тропонин, тропомиозин – мышц сердца.
- Протеины принимают сигналы из внешней среды и передают команды в клетку. Под воздействием факторов внешней среды сигнальные белки изменяют свою третичную структуру, что в свою очередь запускает цепь биохимических процессов. Так родопсин реагирует на свет, преобразуя световую энергию в электрическую, которая передается по нервным клеткам в головной мозг, где формируется зрительная картинка.
- Протеины являются ферментами – катализаторами, благодаря которым возможно протекание биохимических реакций при низких температурах (37 0 С).
- Протеины – регуляторы включают и выключают гены клетки, тем самым подавляя либо активируя биохимические процессы.
- Протеины, как правило, не накапливаются в организме, за исключением альбумина яйца и казеина молока. Лишних белков в организме нет. Однако, они могут соединяться с другими веществами и микроэлементами, препятствуя их выведению из организма. Так ферритин образует комплекс с железом, высвобождающимся при распаде гемоглобина, и вновь включает его в биологические процессы.
- Протеины могут давать энергию. При распаде 1 г. белка выделяется 4 ккал (17,6 кДж). В качестве источника энергии белки используются при истощении других, нормативных источников – углеводов и жиров. Перефразируя Д.И.Менделеева, можно сказать, что топить белками, это все равно что топить ассигнациями, настолько они ценны для организма.
Что представляет собой молекула жизни?
Это длинная цепочка, т.е. полимер, состоящая из мономеров – аминокислот. Почему аминокислот? Потому что у каждой молекулы есть хвост органической кислоты C-O-OH и аминогруппа NH 2 . В цепочке-полимере каждый мономер – аминокислота присоединяет свой кислотный остаток к аминогруппе другого мономера, получается прочная связь, именуемая пептидной .
Понятия белок и пептид близки, но не равнозначны. Обычно пептидами называют некоторую последовательность аминокислотных остатков. Выделяют олигопептиды – короткие цепочки в 10-15 аминокислот и полипептиды – длинные цепочки аминокислотных последовательностей. Белок – это полипептид, имеющий особую форму пространственной организации.

Нанизывая аминокислоты, как бусинки в ожерелке, формируется первичная структура белка, т.е. последовательность аминокислотных остатков.\
В пространстве белок существует не в виде вытянутой нитки, а завивается спиралью, т.е. формирует вторичную структуру.

Спиралька сворачивается в шарик – глобулу, это уже третичная структура белка.
Некоторые белки (не все) имеют четвертичную структуру , объединяя в своем составе несколько молекул, каждая со своей первичной, вторичной и третичной структурой.
Зачем это надо знать? Потому что переваривание и усвоение белка напрямую зависит от его структуры: чем плотнее упакован белок в составе пищевого продукта, тем тяжелее он поддается перевариванию, тем больше энергии надо затратить на его усвоение.
Распад связей в молекуле белка называется денатурацией . Денатурация может быть обратимой, когда белок восстанавливает структуру, и необратимой. Необратимой денатурации белки подвергаются в том числе при воздействии высокой температуры – для человека это свыше 42 0 С, именно поэтому лихорадка опасна для жизни.
Мы подвергаем белки контролируемой денатурации в процессе приготовления пищи, когда варим мясо или рыбу, кипятим молоко, жарим или варим яйца, варим каши и печем хлеб. При мягком температурном воздействии, белки с распавшимися связями становятся более доступными для пищеварительных ферментов и лучше усваиваются организмом. При длительном и жестком температурном воздействии – жарке на углях, длительной варке – происходит вторичная денатурация белка с образованием трудноперевариваемых соединений.
Аминокислоты
Существует более двух сотен различных аминокислот, но в составе белков — полимеров постоянно встречаются лишь двадцать. Эти 20 «магических» аминокислот делятся на две неравные группы: заменимые, т.е. те, которые могут вырабатываться самим организмом, и незаменимые (эссенциальные), они организмом человека не вырабатываются, и мы должны в обязательном порядке получать их с пищей.
К заменимым аминокислотам относятся: Аланин, Аргинин, Аспаргин, Аспарагиновая кислота, Глицин, Глутамин, Глутаминовая кислота, Пролин, Серин, Тирозин, Цистин.
Незаменимые аминокислоты: Валин, Изолейцин, Лейцин, Лизин, Метионин, Трионин, Триптофан, Фенилаланин
Для детей незаменимыми аминокислотами являются Аргинин и Гистидин.
По аминокислотам будет отдельный пост.
Классификация белков
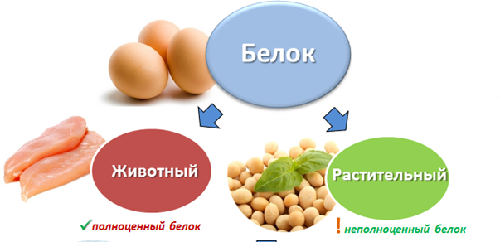
Полноценный белок содержит в своем составе все необходимые аминокислоты, а неполноценный белок, соответственно, каких-то аминокислот не содержит.
Для строительства всех белков организма важно не только наличие всех аминокислот, но и их пропорции в пищевом продукте. Пища, наиболее близкая по аминокислотному составу белкам тела человека, является оптимальной. Если какой-то одной аминокислоты не хватает, другие аминокислоты не могут использоваться организмом, более того, для того, чтобы возместить нехватку, начнут распадаться собственные белки, в первую очередь белки – ферменты, участвующие в процессах биосинтеза, и мышечные белки. В условиях недостатка той или иной незаменимой аминокислоты, другие аминокислоты оказываются избыточными, хотя этот избыток относительный. Распадающиеся мышечные белки образуют высокотоксичные продукты обмена и усиленно выводятся организмом, создавая отрицательных азотистый баланс. Человек начинает хиреть, хотя может искренне считать, что с питанием у него все в порядке.
По своему происхождению белки делятся на животные и растительные.
К животным белкам относятся белки яиц, молока и молочных продуктов, рыбы и морепродуктов, мясо животных и птиц.
К растительным белкам относятся белки зерновых, бобовых, орехов и грибов.
Продукты питания считаются белковыми, если они содержат не меньше 15% белка.
Все животные белки являются полноценными, т.е. содержат полный набор аминокислот. Большинство растительных белков являются неполноценными.
При недостаточном поступлении белка с пищей в организме развиваются дегенеративные процессы, связанные с невозможностью выполнять необходимые функции. В первую очередь страдает иммунитет. Человек становится предрасположен к вирусным и бактериальным инфекциям, болезни приобретают затяжной, хронический характер. Начинают выпадать волосы, кожа становится дряблой, морщинистой. Страдает волевая сфера, человека охватывает апатия, полное нежелание чем-либо заниматься, присоединяется депрессия. Уменьшается мышечная масса, замедляется обмен веществ. Начинаются проблемы с пищеварением, появляется т.н. «синдром раздраженного кишечника», когда прием пищи сопровождается метеоризмом, поносы сменяются запорами и наоборот. Угнетается детородная функция, у женщин прекращаются месячные. В тяжелых случаях начинаются структурные изменения в органах и тканях, видимое истощение. Белковое голодание детей приводит к умственной отсталости.
Тяжелое белковое голодание в наше время в цивилизованных странах, куда мы относим и нашу страну, если исключить заболевания, типа туберкулеза или онкологии, встречаются у людей, практикующих безумные голодные диеты в маниакальном стремлении похудеть.
Последнее сообщение касалось Анджелины Джоли, ее госпитализировали с весом 35 кг – такими застали советские освободители узников нацистских конц.лагерей. Вряд ли живые скелеты являли собой образцы красоты.
Однако недостаток белка – не такое уж редкое состояние, объясняющееся нездоровой структурой питания, сложившейся вследствие относительной дороговизны белковых продуктов. В стремлении сэкономить люди переходят на углеводно-жировую диету с потреблением неполноценного растительного белка. Свою лепту вносят полуфабрикаты, изготовленные из суррогатов и белковыми продуктами не являющимися. Так человек, покупающий готовые котлеты, колбасу, сосиски может искренне считать, что потребляет достаточно белка. Не заблуждайтесь.
В следующей статье вы узнаете, сколько и какого белка необходимо человеку, чтобы оставаться здоровым.
Оставляйте комментарии, делитесь информацией в социальных сетях. Галина Баева.
Белки - одни из важных органических элементов любой живой клетки организма. Они выполняют множество функций: опорную, сигнальную, ферментативную, транспортную, структурную, рецепторную и т. д. Важным эволюционным приспособлением стали первичная, вторичная, третичная и четвертичная структуры эти молекулы? Почему так важна правильная конформация протеинов в клетках организма?
Структурные компоненты белков
Мономерами любой полипептидной цепи являются аминокислоты (АК). Эти низкомолекулярные органические соединения достаточно распространены в природе и могут существовать как самостоятельные молекулы, выполняющие свойственные им функции. Среди них транспорт веществ, рецепция, ингибирование или активация ферментов.
Всего насчитывается около 200 биогенных аминокислот, однако только 20 из них могут быть мономерами белков. Они легко растворяются в воде, имеют кристаллическую структуру и многие из них сладкие на вкус.
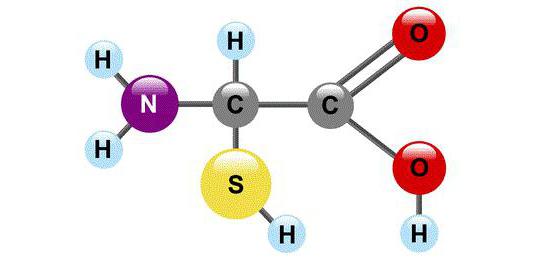
С химической точки зрения АК - это молекулы, в составе которых обязательно присутствуют две функциональные группы: -СООН и -NH2. С помощью этих групп аминокислоты образуют цепочки, соединяясь друг с другом пептидной связью.
Каждая из 20 протеиногенных аминокислот имеет свой радикал, в зависимости от которого разнятся химические свойства. По составу таких радикалов все АК классифицируются на несколько групп.
- Неполярные: изолейцин, глицин, лейцин, валин, пролин, аланин.
- Полярные и незаряженные: треонин, метионин, цистеин, серин, глутамин, аспарагин.
- Ароматические: тирозин, фенилаланин, триптофан.
- Полярные и заряженные отрицательно: глутамат, аспартат.
- Полярные и заряженные положительно: аргинин, гистидин, лизин.
Любой уровень организации структуры белка (первичный, вторичный, третичный, четвертичный) в основе имеет полипептидную цепь, состоящую из АК. Разница лишь в том, как эта последовательность складывается в пространстве и с помощью каких химических связей такая конформация поддерживается.
Первичная структура белка
Любой протеин образуется на рибосомах - немембранных органеллах клетки, которые участвуют в синтезе полипептидной цепочки. Здесь аминокислоты соединяются друг с другом с помощью прочной пептидной связи, образуя первичную структуру. Однако такая первичная структура белка от четвертичной крайне отличается, поэтому необходимо дальнейшее созревание молекулы.
Такие белки, как эластин, гистоны, глутатион, уже с такой простейшей структурой способны выполнять свои функции в организме. Для подавляющего же числа протеинов следующим этапом становится образование более сложной вторичной конформации.

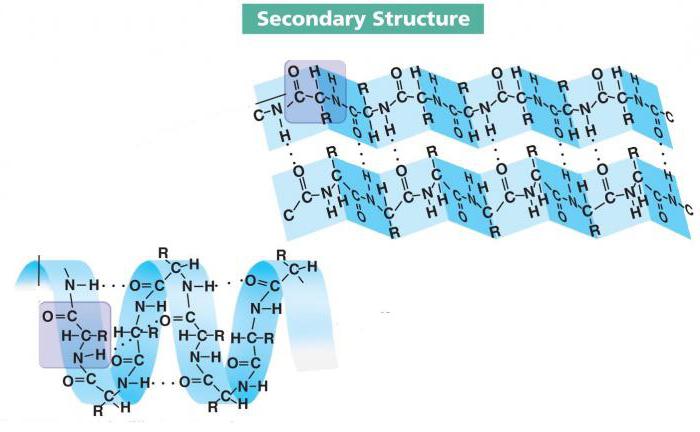
Вторичная структура белка
Образование пептидных связей - это первый этап созревания большинства белков. Чтобы они могли выполнять свои функции, их локальная конформация должна претерпеть некоторые изменения. Достигается это с помощью водородных связей - непрочных, но в то же время многочисленных соединений между основным и кислотным центрами молекул аминокислот.
Так формируется вторичная структура белка, от четвертичной отличающаяся простотой комплектации и локальной конформацией. Последнее означает, что не вся цепь подвергается преобразованию. Водородные связи могут образовываться на нескольких участках разной отдаленности друг от друга, причем их форма также зависит от типа аминокислот и способа комплектации.
Лизоцим и пепсин - это представители белков, имеющих вторичную структуру. Пепсин участвует в процессах пищеварения, а лизоцим выполняет защитную функцию в организме, разрушая клеточные стенки бактерий.
Особенности вторичной структуры
Локальные конформации пептидной цепи могут отличаться друг от друга. Их уже изучено несколько десятков, и три из них являются наиболее распространенными. Среди них альфа-спираль, бета-слои и бета-поворот.
- Альфа-спираль - одна из часто встречающихся конформаций вторичной структуры большинства белков. Представляет собой жесткий стержневой каркас с ходом в 0,54 нм. Радикалы аминокислот направлены наружу.
Наиболее распространены правозакрученные спирали, и иногда можно найти левозакрученные аналоги. Формообразующую функцию выполняют водородные связи, которые стабилизируют завитки. Цепь, которая образует альфа-спираль, содержит очень мало пролина и полярных заряженных аминокислот.
- Бета-поворот выделяют в отдельную конформацию, хотя это можно назвать частью бета-слоя. Суть заключается в изгибе пептидной цепочки, который поддерживается водородными связями. Обычно само место изгиба состоит из 4-5 аминокислот, среди которых обязательно наличие пролина. Эта АК единственная имеет жесткий и короткий скелет, что позволяет образовать сам поворот.
- Бета-слой представляет собой цепочку аминокислот, которая образует несколько изгибов и стабилизирует их водородными связями. Такая конформация очень напоминает сложенный в гармошку лист бумаги. Чаще всего такую форму имеют агрессивные белки, однако встречается немало исключений.
Различают параллельный и антипараллельный бета-слой. В первом случае С- и N- концы в местах изгиба и на концах цепи совпадают, а во втором случае нет.
Третичная структура
Дальнейшая упаковка белка приводит к формированию третичной структуры. Стабилизируется такая конформация с помощью водородных, дисульфидных, гидрофобных и ионных связей. Их большое количество позволяет скрутить вторичную структуру в более сложную форму и стабилизировать ее.
Разделяют глобулярные и Молекула глобулярных пептидов представляет собой шаровидную структуру. Примеры: альбумин, глобулин, гистоны в третичной структуре.
Формируют прочные тяжи, длина которых превышает их ширину. Такие протеины чаще всего выполняют структурную и формообразующую функции. Примерами служат фиброин, кератин, коллаген, эластин.
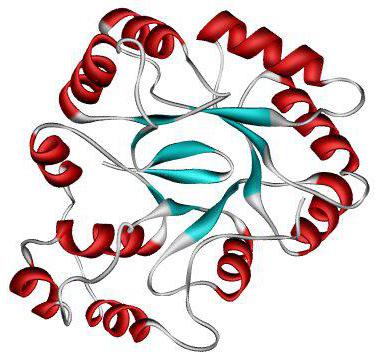
Структура белков в четвертичной структуре молекулы
Если несколько глобул объединяются в один комплекс, формируется так называемая четвертичная структура. Такая конформация характерна не для всех пептидов, и она образуется при необходимости выполнения важных и специфических функций.
Каждая глобула в составе представляет собой отдельный домен или протомер. В совокупности молекулы называется олигомером.
Обычно такой белок имеет несколько устойчивых конформаций, которые постоянно сменяют друг друга либо в зависимости от воздействия каких-либо внешних факторов, либо при необходимости выполнения разных функций.
Важным отличием третичной структуры белка от четвертичной являются межмолекулярные связи, которые и отвечают за соединение нескольких глобул. В центре всей молекулы часто располагается ион металла, который напрямую влияет на образование межмолекулярных связей.
Дополнительные структуры белка
Не всегда цепочки аминокислот достаточно для выполнения функций белка. В большинстве случаев к таким молекулам присоединяются другие вещества органической и неорганической природы. Т. к. эта особенность характерна для подавляющего числа ферментов, состав сложных протеидов принято делить на три части:
- Апофермент - это белковая часть молекулы, представляющая собой аминокислотную последовательность.
- Кофермент - не белковая, но органическая часть. В ее состав могут входить различные типы липидов, углеводов или даже нуклеиновых кислот. Сюда относятся и представители биологически активных соединений, среди которых встречаются витамины.
- Кофактор - неорганическая часть, представленная в подавляющем большинстве случаев ионами металлов.
Структура белков в четвертичной структуре молекулы требует участия нескольких молекул разного происхождения, поэтому многие ферменты имеют сразу три составляющие. Примером служит фосфокиназа - фермент, обеспечивающий перенос фосфатной группы от молекулы АТФ.
Где образуется четвертичная структура молекулы белка?
Полипептидная цепь начинает синтезироваться на рибосомах клетки, однако дальнейшее созревание протеина происходит уже в других органеллах. Новообразованная молекула должна попасть в транспортную систему, которая состоит из ядерной мембраны, ЭПС, аппарата Гольджи и лизосом.
Усложнение пространственного строения белка происходит в эндоплазматической сети, где не только формируются различные виды связей (водородные, дисульфидные, гидрофобные, межмолекулярные, ионные), но и присоединяются кофермент и кофактор. Так образуется четвертичная структура белка.
Когда молекула полностью готова к работе, она попадает либо в цитоплазму клетки, либо в аппарат Гольджи. В последнем случае эти пептиды упаковываются в лизосомы и транспортируются к другим компартментам клетки.
Примеры олигомерных белков
Четвертичная структура - это структура белков, которая призвана способствовать выполнению жизненно важных функций в живом организме. Сложная конформация органических молекул позволяет, прежде всего, влиять на работу многих метаболических процессов (ферменты).
Биологически важными белками являются гемоглобин, хлорофилл и гемоцианин. Порфириновое кольцо является основой этих молекул, в центре которых - ион металла.
Гемоглобин
Четвертичная структура молекулы белка гемоглобина представляет собой 4 глобулы, соединенных межмолекулярными связями. В центре - порфин с ионом двухвалентного железа. Белок переносится в цитоплазме эритроцитов, где занимают около 80 % всего объема цитоплазмы.
Основой молекулы является гем, который имеет больше неорганическую природу и окрашен в красный цвет. Также это первичный продукт распада гемоглобина в печени.
Все мы знаем, что гемоглобин выполняет важную транспортную функцию - перенос кислорода и углекислого газа по организму человека. Сложная конформация молекулы белка формирует специальные активные центры, которые и способны связывать соответствующие газы с гемоглобином.
Когда образуется комплекс "белок-газ", формируются так называемые оксигемоглобин и карбогемоглобин. Однако есть еще одна разновидность таких объединений, которая достаточно устойчива: карбоксигемоглобин. Представляет собой комплекс из белка и угарного газа, устойчивость которого объясняет приступы удушья при чрезмерной токсикации.

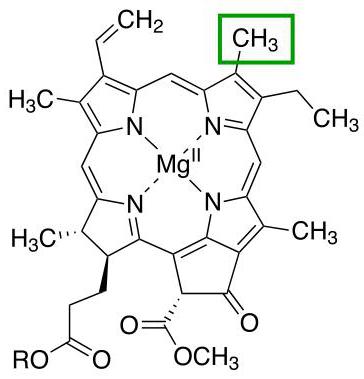
Хлорофилл
Еще один представитель белков с четвертичной структурой, связи доменов которого поддерживает уже ион магния. Главная функция всей молекулы - участие в процессах фотосинтеза у растений.
Существуют различные типы хлорофиллов, которые отличаются друг от друга радикалами порфиринового кольца. Каждая из этих разновидностей отмечается отдельной буквой латинского алфавита. Например, для наземных растений характерно наличие хлорофилла а или хлорофилла b, а у водорослей встречаются и другие типы этого белка.
Гемоцианин
Эта молекула - аналог гемоглобина у многих низших животных (членистоногие, моллюски и т. д.). Основным отличием структуры белка с четвертичной структурой молекулы является наличие иона цинка вместо иона железа. Гемоцианин имеет голубоватый цвет.
Иногда люди задаются вопросом о том, что было бы, если заменить гемоглобин человека гемоцианином. В таком случае нарушается привычное содержание веществ в крови, а в частности аминокислот. Также гемоцианин нестабильно образует комплекс с углекислым газом, поэтому «голубая кровь» имела бы склонность к образованию тромбов.
Более 4 млрд лет назад на Земле из маленьких неорганических молекул непостижимым образом возникли белки, ставшие строительными бло-ками живых организмов. Своим бес-конечным разнообразием всё живое обязано именно уникальным молеку-лам белка, и иные формы жизни во Вселенной науке пока неизвестны.
Белки, или протеины (от греч. «протос» — «первый»), — это природ-ные органические соединения, кото-рые обеспечивают все жизненные процессы любого организма. Из бел-ков построены хрусталик глаза и па-утина, панцирь черепахи и ядовитые вещества грибов... С помощью белков мы перевариваем пищу и боремся с болезнями. Благодаря особым белкам по ночам светятся светлячки, а в глу-бинах океана мерцают таинствен-ным светом медузы.
Белковых молекул в живой клетке во много раз больше, чем всех других (кроме воды, разумеется!). Учёные вы-яснили, что у большинства организ-мов белки составляют более полови-ны их сухой массы. И разнообразие видов белков очень велико — в одной клетке такого маленького организма, как бактерия Escherichia сой" (см. до-полнительный очерк «Объект иссле-дования — прокариоты»), насчиты-вается около 3 тыс. различных белков.
Впервые белок был выделен (в ви-де клейковины) в 1728 г. итальянцем Якопо Бартоломео Беккари (1682— 1766) из пшеничной муки. Это собы-тие принято считать рождением хи-мии белка. С тех пор почти за три столетия из природных источников получены тысячи различных белков и исследованы их свойства.
БИОЛОГИЧЕСКИЕ «БУСЫ»
Молекула белка очень длинная. Хими-ки называют такие молекулы поли-мерными (от греч. «поли» — «много» и «мерос» — «часть», «доля»). Действи-тельно, длинная молекула полимера состоит из множества маленьких мо-лекул, связанных друг с другом. Так нанизываются на нить бусинки в ожерелье. В полимерах роль нити иг-рают химические связи между бусин-ками-молекулами.
Секрет белков спрятан в особен-ностях этих самых бусинок. Боль-шинство полимеров не принимает устойчивой формы в пространстве, уподобляясь тем же бусам, у которых и не может быть пространственной структуры: повесишь их на шею — они примут форму кольца или овала, положишь в коробку — свернутся в клубок неопределённой формы. А те-перь представим себе, что некоторые бусинки могут «слипаться» друг с другом. Например, красные притяги-ваются к жёлтым. Тогда вся цепочка примет определённую форму, обязан-ную своим существованием «слипа-нию» жёлтых и красных бусинок
Нечто подобное происходит и в белках. Отдельные маленькие моле-кулы, входящие в состав белка, обла-дают способностью «слипаться», так как между ними действуют силы при-тяжения. В результате у любой белко-вой цепи есть характерная только для неё пространственная структура. Именно она определяет чудесные свойства белков. Без такой структуры они не могли бы выполнять те функ-ции, которые осуществляют в живой клетке.
При длительном кипячении бел-ков в присутствии сильных кислот или щелочей белковые цепи распада-ются на составляющие их молекулы,
Называемые аминокислотами. Амино-кислоты — это и есть те «бусинки», из которых состоит белок, и устроены они сравнительно просто.
КАК УСТРОЕНА АМИНОКИСЛОТА
В каждой молекуле аминокислоты есть атом углерода, связанный с четырьмя заместителями. Один из них — атом водорода, второй — кар-боксильная группа —СООН. Она лег-ко «отпускает на волю» ион водоро-да Н+, благодаря чему в названии аминокислот и присутствует слово «кислота». Третий заместитель — ами-ногруппа — NH 2 и, наконец, четвёр-тый заместитель — группа атомов, ко-торую в общем случае обозначают R . У всех аминокислот R-группы разные, и каждая из них играет свою, очень важную роль.
Свойства «бусинок», отличающие одну аминокислоту от другой, скры-ты в R-группах (их ещё называют бо-ковыми цепями). Что же касается группы — СООН, то химики-органи-ки относятся к ней с большим почте-нием: всем другим атомам углерода в молекуле даются обозначения в зави-симости от степени их удалённости от карбоксильной группы. Ближай-ший к ней атом именуют а-атомом, второй — в-атомом, следующий — у -атомом и т. д. Атом углерода в ами-нокислотах, который находится бли-же всех к карбоксильной группе, т. е. а-атом, связан также с аминогруппой, поэтому природные аминокислоты, входящие в состав белка, называют а-аминокислотами.
В природе встречаются также ами-нокислоты, в которых NH^-группа связана с более отдалёнными от кар-боксильной группы атомами углеро-да. Однако для построения белков природа выбрала именно а-аминокислоты. Это обусловлено прежде всего тем, что только а-аминокислоты, соединённые в длинные цепи, способны обеспечить достаточную прочность и устойчивость структуры больших белковых молекул.
Число а-аминокислот, различа-ющихся R-группой, велико. Но чаще других в белках встречается всего 20 разных аминокислот. Их можно рас-сматривать как алфавит «языка» бел-ковой молекулы. Химики называют эти главные аминокислоты стандарт-ными, основными или нормальными. Условно основные аминокислоты де-лят на четыре класса.
В первый входят аминокислоты с неполярными боковыми цепями. Во второй — аминокислоты, со-держащие полярную группу. Следую-щие два составляют аминокислоты с боковыми цепями, которые могут заряжаться положительно (они объе-диняются в третий класс) или отрица-тельно (четвёртый). Например, диссо-циация карбоксильной группы даёт анион — СОО-, а протонирование ато-ма азота — катион, например — NH 3 + . Боковые цепи аспарагиновой и глута-миновой кислот имеют ещё по одной карбоксильной группе —СООН, кото-рая при значениях рН, характерных для живой клетки (рН = 7), расстаётся с ионом водорода (Н+) и приобрета-ет отрицательный заряд. Боковые це-пи аминокислот лизина, аргинина и гистидина заряжены положительно, поскольку у них есть атомы азота, ко-торые, наоборот, могут ион водорода присоединять.
Каждая а-аминокислота (кроме глицина) в зависимости от взаимно-го расположения четырёх заместите-лей может существовать в двух фор-мах. Они отличаются друг от друга, как предмет от своего зеркального от-ражения или как правая рука от ле-вой. Такие соединения получили название хоральных (от грен. «хир» — «рука»). Хиральные молекулы открыл в 1848 г. великий французский учё-ный Луи Пастер. Два типа оптических изомеров органических молекул по-лучили названия Д-форма (от лат. dexter — «правый») и Z-форма (от лат. laevus — «левый»). Кстати, одно из названий других хиральных моле-кул — глюкозы и фруктозы — декст-роза и левулоза. Примечательно, что в состав белков входят только Z-ами нокислоты, и вся белковая жизнь на Земле — «левая».
Для нормальной жизнедеятельно-сти организм нуждается в полном на-боре из 20 основных a-Z-аминокислот. Но одни из них могут быть синтезиро-ваны в клетках самого организма, а другие — должны поступать в готовом виде из пищевых продуктов. В пер-вом случае аминокислоты называют заменимыми, а во втором — незамени-мыми. Набор последних для разных организмов различен. Например, для белой крысы незаменимыми являют-ся 10 аминокислот, а для молочнокислых бактерий — 16. Растения могут са-мостоятельно синтезировать самые разнообразные аминокислоты, созда-вать такие, которые не встречаются в белках.
Для удобства 20 главных амино-кислот обозначают символами, ис-пользуя одну или первые три буквы русского или английского названия аминокислоты, например аланин — Ала или А, глицин — Гли или G .
ЧТО ТАКОЕ ПЕПТИД
Полимерная молекула белка образует-ся при соединении в длинную цепоч-ку бусинок-аминокислот. Они нани-зываются на нить химических связей благодаря имеющимся у всех амино-кислот амино- и карбоксильной груп-пам, присоединённым к а-атому угле-рода.
Образующиеся в результате такой реакции соединения называются пеп-тидами; (—СО— NH —группировка в них — это пептидная группа, а связь между атомами углерода и азота — пептидная связь (её ещё называют амидной). Соединяя аминокислоты посредством пептидных связей, мож-но получить пептиды, состоящие из остатков очень многих аминокислот. Такие соединения получили название полипептиды. Полипептидное стро-ение белковой молекулы доказал в 1902 г. немецкий химик Эмиль Гер-ман Фишер.
На концах аминокислотной це-почки находятся свободные амино-и карбоксильная группы; эти концы цепочки называют N - и С-концами. Аминокислотные остатки в полипеп-тидной цепочке принято нумеровать с N-конца.
Общее число аминокислотных ос-татков в белковой молекуле изменя-ется в очень широких пределах. Так, человеческий инсулин состоит из 51 аминокислотного остатка, а лизо-цим молока кормящей матери — из 130. В гемоглобине человека 4 ами-нокислотные цепочки, каждая из которых построена из примерно 140 аминокислот. Существуют белки, имеющие почти 3 тыс. аминокис-лотных остатков в единой цепи.
Молекулярные массы белков лежат в диапазоне примерно от 11 тыс. для малых белков, состоящих из 100 ами-нокислотных остатков, до 1 млн и бо-лее для белков с очень длинными полипептидными цепями или для белков, состоящих из нескольких по-липептидных цепей.
Возникает вопрос: как же всё ог-ромное многообразие белков с раз-личными функциями и свойствами может быть создано всего из 20 мо-лекул? А разгадка этого секрета при-роды проста — каждый белок имеет свой неповторимый аминокислот-ный состав и уникальный порядок со-единения аминокислот, называемый первичной структурой белка.
СПИРАЛИ И СЛОИ
В начале 50-х гг. XX в. американские химики Лайнус Карл Полинг (1901— 1994), награждённый Нобелевской премией за исследования природы химической связи, и Роберт Кори (1897—1971) предположили, что не-которые участки аминокислотной це-почки в белках закручены в спираль. Благодаря совершенствованию экс-периментальных методов (структуру белков изучают с помощью рентгенов-ских лучей) через несколько лет эта гениальная догадка подтвердилась.
Действительно, полипептидные цепи очень часто образуют спираль, закрученную в правую сторону. Это первый, самый низкий уровень про-странственной организации белко-вых цепочек Здесь-то и начинают иг-рать роль слабые взаимодействия «бусинок»-аминокислот: группа С=0 и группа N — H из разных пептидных связей могут образовывать между со-бой водородную связь. Оказалось, что в открытой Полингом и Кори спирали такая связь образована меж-ду группой С=0 каждой г-й аминокис-лоты и группой N — H (i + 4)-й амино-кислоты, т. е. между собой связаны аминокислотные остатки, отстоящие друг от друга на четыре «бусинки». Эти водородные связи и стабилизиру-ют такую спираль в целом. Она полу-чила название a.-спирали.
Позднее выснилось, что а-спираль — не единственный способ ук-ладки аминокислотных цепочек. По-мимо спиралей они образуют ещё и слои. Благодаря всё тем же водород-ным связям между группами С=0 и N — H друг с другом могут «слипаться» сразу несколько разных фрагментов одной полипептидной цепи. В резуль-тате получается целый слой — его на-звали ^-слоем.
В большинстве белков а-спирали и р-слои перемежаются всевозможными изгибами и фрагментами цепи без какой-либо определённой структуры. Когда имеют дело с пространствен-ной структурой отдельных участков белка, говорят о вторичной структу-ре белковой молекулы.
БЕЛОК В ПРОСТРАНСТВЕ
Для того чтобы получить полный «портрет» молекулы белка, знания первичной и вторичной структуры недостаточно. Эти сведения ещё не дают представления ни об объёме, ни о форме молекулы, ни тем более о расположении участков цепи по отношению друг к другу. А ведь все спирали и слои каким-то образом размещены в пространстве. Общая пространственная структура поли-пептидной цепи называется третич-ной структурой белка.
Первые пространственные модели молекул белка — миоглобина и гемо-глобина — построили в конце 50-х гг. XX в. английские биохимики Джон Ко-удери Кендрю (родился в 1917 г.) и Макс Фердинанд Перуц (родился в 1914 г.). При этом они использовали данные экспериментов с рентгенов-скими лучами. За исследования в об-ласти строения белков Кендрю и Перуц в 1962 г. были удостоены Нобе-левской премии. А в конце столетия была определена третичная структура уже нескольких тысяч белков.
При образовании третичной струк-туры белка наконец-то проявляют активность R-группы — боковые це-пи аминокислот. Именно благодаря им «слипаются» между собой боль-шинство «бусинок»-аминокислот, придавая цепи определённую форму в пространстве.
В живом организме белки всегда находятся в водной среде. А самое большое число основных аминокис-лот — восемь — содержат неполяр-ные R-группы. Разумеется, белок стремится надёжно спрятать внутрь своей молекулы неполярные боковые цепи, чтобы ограничить их контакт с водой. Учёные называют это воз-никновением гидрофобных взаимо-действий (см. статью «Мельчайшая единица живого»).
Благодаря гидрофобным взаимо-действиям вся полипептидная цепоч-ка принимает определённую форму в пространстве, т. е. образует третич-ную структуру.
В молекуле белка действуют и дру-гие силы. Часть боковых цепей основ-ных аминокислот заряжена отрица-тельно, а часть — положительно. Так как отрицательные заряды притяги-ваются к положительным, соответст-вующие «бусинки» «слипаются». Элек-тростатические взаимодействия, или, как их называют иначе, солевые мос-тики, — ещё одна важная сила, ста-билизирующая третичную структуру.
У семи основных аминокислот есть полярные боковые цепи. Между ними могут возникать водородные связи, тоже играющие немалую роль в поддержании пространственной структуры белка.
Между двумя аминокислотными остатками цистеина иногда образу-ются ковалентные связи (— S —S—), которые очень прочно фиксируют расположение разных участков бел-ковой цепи по отношению друг к другу. Такие связи называют дисуль-фидными мостиками. Это самые не-многочисленные взаимодействия в белках (в некоторых случаях они во-обще отсутствуют), зато по прочно-сти они не имеют равных.
ВЫСШИЙ УРОВЕНЬ ПРОСТРАНСТВЕННОЙ ОРГАНИЗАЦИИ БЕЛКОВ
Молекула белка может состоять не из одной, а из нескольких полипептидных цепей. Каждая такая цепь представляет собой самостоятельную пространственную структуру — субь-единицу. Например, белок гемогло-бин состоит из четырёх субъединиц, которые образуют единую молекулу, располагаясь в вершинах почти пра-вильного тетраэдра. Субъединицы «прилипают» друг к другу благодаря тем же самым силам, что стабилизи-руют третичную структуру. Это гид-рофобные взаимодействия, солевые мостики и водородные связи.
Если белок состоит из нескольких субъединиц, говорят, что он обладает четвертичной структурой. Такая структура представляет собой высший уровень организации белковой моле-кулы. В отличие от первых трёх уров-ней четвертичная структура есть дале-ко не у всех белков. Приблизительно половина из известных на сегодняш-ний день белков её не имеют.
ПОЧЕМУ БЕЛКИ БОЯТСЯ ТЕПЛА
Связи, поддерживающие пространст-венную структуру белка, довольно лег-ко разрушаются. Мы с детства знаем, что при варке яиц прозрачный яич-ный белок превращается в упругую белую массу, а молоко при скисании загустевает. Происходит это из-за раз-рушения пространственной структуры белков альбумина в яичном белке и ка-зеина (огглат. caseus — «сыр») в моло-ке. Такой процесс называется денату-рацией. В первом случае её вызывает нагревание, а во втором — значи-тельное увеличение кислотности (в результате жизнедеятельности обита-ющих в молоке бактерий). При дена-турации белок теряет способность выполнять присущие ему в организме функции (отсюда и название процес-са: от лат. denaturare — «лишать при-родных свойств»). Денатурированные белки легче усваиваются организмом, поэтому одной из целей термической обработки пищевых продуктов яв-ляется денатурация белков.
ЗАЧЕМ НУЖНА ПРОСТРАНСТВЕННАЯ СТРУКТУРА
В природе почти ничего не происхо-дит случайно. Если белок принял определённую форму в пространстве, это должно служить достижению ка-кой-то цели. Действительно, только бе-лок с «правильной» пространственной структурой может обладать опреде-лёнными свойствами, т. е. выполнять те функции в организме, которые ему предписаны. А делает он это с помо-щью всё тех же R-групп аминокислот. Оказывается, боковые цепи не толь-ко поддерживают «правильную» фор-му молекулы белка в пространстве. R-группы могут связывать другие орга-нические и неорганические молекулы, принимать участие в химических ре-акциях, выступая, например, в роли ка-тализатора.
Часто сама пространственная ор-ганизация полипептидной цепи как раз" и нужна для того, чтобы сосредо-точить в определённых точках про-странства необходимый для выполне-ния той или иной функции набор боковых цепей. Пожалуй, ни один процесс в живом организме не прохо-дит без участия белков.
В ЧЁМ СЕКРЕТ ФЕРМЕНТОВ
Все химические реакции, протекаю-щие в клетке, происходят благодаря особому классу белков — фермен-там. Это белки-катализаторы. У них есть свой секрет, который позволяет им работать гораздо эффективнее других катализаторов, ускоряя реак-ции в миллиарды раз.
Предположим, что несколько при-ятелей никак не могут встретиться. Но стоило одному из них пригласить друзей на день рождения, как резуль-тат не заставил себя ждать: все оказа-лись в одном месте в назначенное время.
Чтобы встреча состоялась, понадо-билось подтолкнуть друзей к контак-ту. То же самое делает и фермент. В его молекуле есть так называемые центры связывания. В них расположе-ны привлекательные для определён-ного типа химических соединений (и только для них!) «уютные кресла» — R-группы, связывающие какие-то уча-стки молекул реагирующих веществ. Например, если одна из молекул име-ет неполярную группу, в центре свя-зывания находятся гидрофобные бо-ковые цепи. Если же в молекуле есть отрицательный заряд, его будет под-жидать в молекуле фермента R-груп па с положительным зарядом.
В результате обе молекулы реаген-тов связываются с ферментом и ока-зываются в непосредственной близо-сти друг от друга. Мало того, те их группы, которые должны вступить в химическую реакцию, сориентирова-ны в пространстве нужным для реак-ции образом. Теперь за дело прини-маются боковые цепи фермента, играющие роль катализаторов. В фер-менте все «продумано» таким обра-зом, что R-группы-катализаторы тоже расположены вблизи от места собы-тий, которое называют активным центром. А после завершения реак-ции фермент «отпускает на волю» мо-лекулы-продукты (см. статью «Фер-менты — на все руки мастера»).
ОТКУДА БЕРЁТСЯ ИММУНИТЕТ
Белки выполняют в организме мно-жество функций; они, например, за-щищают клетки от нежелательных вторжений, предохраняют их от по-вреждений. Специальные белки — антитела обладают способностью распознавать проникшие в клетки бактерии, вирусы, чужеродные поли-мерные молекулы и нейтрализовывать их.
У высших позвоночных от чуже-родных частиц организм защищает иммунная система. Она устроена так, что организм, в который вторг-лись такие «агрессоры» — антигены, начинает вырабатывать антитела. Молекула антитела прочно связыва-ется с антигеном: у антител, как и у ферментов, тоже есть центры связы-вания. Боковые цепи аминокислот расположены в центрах таким обра-зом, что антиген, попавший в эту ло-вушку, уже не сможет вырваться из «железных лап» антитела. После свя-зывания с антителом враг выдворяет-ся за пределы организма.
Можно ввести в организм неболь-шое количество некоторых полимер-ных молекул, входящих в состав бак-терий или вирусов-возбудителей какой-либо инфекционной болезни.
В организме немедленно появятся соответствующие антитела. Теперь попавший в кровь или лимфу «насто-ящий» болезнетворный микроб тот-час же подвергнется атаке этих анти-тел, и болезнь будет побеждена. Такой способ борьбы с инфекцией есть не что иное, как нелюбимая многими прививка. Благодаря ей организм приобретает иммунитет к инфекци-онным болезням.
ДЛЯ ЧЕГО В ГЕМОГЛОБИНЕ ЖЕЛЕЗО
В природе существуют белки, в ко-торых помимо аминокислот содер-жатся другие химические компонен-ты, такие, как липиды, сахара, ионы металлов. Обычно эти компоненты играют важную роль при выполне-нии белком его биологической функ-ции. Так, перенос молекул и ионов из одного органа в другой осуществля-ют транспортные белки плазмы крови. Белок гемоглобин (от греч. «гема» — «кровь» и лат. globus — «шар», «шарик»), содержащийся в кровяных клетках — эритроцитах (от греч. «эритрос» — «красный» и «китос» — «клетка»), доставляет кис-лород от лёгких к тканям. В молеку-ле гемоглобина есть комплекс иона железа Fe 24 " со сложной органической молекулой, называемый гемам. Гемо-глобин состоит из четырёх белковых субъединиц, и каждая из них содер-жит по одному гему.
В связывании кислорода в лёгких принимает участие непосредственно ион железа. Как только к нему хотя бы в одной из субъединиц присоединя-ется кислород, сам ион тут же чуть-чуть меняет своё расположение в мо-лекуле белка. Движение железа «про-воцирует» движение всей аминокис-лотной цепочки данной субъединицы, которая слегка трансформирует свою третичную структуру.
Другая субъеди-ница, ещё не присоединившая кислород, «чувствует», что произошло с со-седкой. Её структура тоже начинает меняться. В итоге вторая субъедини-ца связывает кислород легче, чем пер-вая. Присоединение кислорода к третьей и четвёртой субъединицам происходит с ещё меньшими трудно-стями. Как видно, субъединицы помо-гают друг другу в работе. Для этого-то гемоглобину и нужна четвертичная структура. Оксид углерода СО (в про-сторечии угарный газ) связывается с железом в геме в сотни раз прочнее кислорода. Угарный газ смертельно опасен для человека, поскольку ли-шает гемоглобин возможности при-соединять кислород.
А ЕЩЁ БЕЛКИ...
Служат питательными веществами. В семенах многих растений (пшени-цы, кукурузы, риса и др.) содержатся пищевые белки. К ним относятся так-же альбумин — основной компонент яичного белка и казеин — главный белок молока. При переваривании в организме человека белковой пищи происходит гидролиз пептидных свя-зей. Белки «разбираются» на отдель-ные аминокислоты, из которых орга-низм в дальнейшем «строит» новые пептиды или использует для полу-чения энергии. Отсюда и название:
Греческое слово «пептос» означает «переваренный». Интересно, что гид-ролизом пептидной связи управляют тоже белки — ферменты.
Участвуют в регуляции клеточ-ной и физиологической активности. К подобным белкам относятся мно-гие гормоны (от греч. «гормао» — «по-буждаю»), такие, как инсулин, регули-рующий обмен глюкозы, и гормон роста.
Наделяют организм способно-стью изменять форму и передвигать-ся. За это отвечают белки актин и ми-озин, из которых построены мышцы.
Выполняют опорную и защитную функции, скрепляя биологические структуры и придавая им прочность. Кожа представляет собой почти чис-тый белок коллаген, а волосы, ногти и перья состоят из прочного нерас-творимого белка кератина.
ЧТО ЗАПИСАНО В ГЕНАХ
Последовательность аминокислот в белках кодируется генами, которые хранятся и передаются по наследству с помощью молекул ДНК (см. статьи «Хранитель наследственной инфор-мации. ДНК» и «Экспрессия генов»). Пространственную структуру белка задаёт именно порядок расположе-ния аминокислот. Получается, что не только первичная, но и вторичная, третичная и четвертичная структуры белков составляют содержание на-следственной информации. Следо-вательно, и выполняемые белками функции запрограммированы гене-тически. Громадный перечень этих функций позволяет белкам по праву называться главными молекулами жизни. Поэтому сведения о белках и есть то бесценное сокровище, кото-рое передаётся в природе от поколе-ния к поколению.
Интерес человека к этим органи-ческим соединениям с каждым годом только увеличивается. Сегодня учёные уже расшифровали структуру многих белковых молекул. Они выясняют функции самых разных белков, пыта-ются определить взаимосвязь функ-ций со структурой. Установление сходства и различий у белков, выпол-няющих аналогичные функции у раз-ных живых организмов, позволяет глубже проникать в тайны эволюции.
АМИНОКИСЛОТЫ — ПОКАЗАТЕЛИ ВОЗРАСТА
D - и L -формы аминокислот обладают способностью очень медленно превращаться друг в друга. За определённый (весьма длительный) период времени чистая D- или I-форма может стать смесью равных количеств обеих форм. Такая смесь называется раиемагом, а сам процесс —раие-мизаиией. Скорость рацемизации зависит от температуры и типа амино-кислоты. Данное свойство можно использовать для определения возрас-та ископаемых остатков организмов, а при необходимости — и живых существ. Например, в белке дентина (дентин — костная ткань зубов) 1-ас-парагиновая кислота самопроизвольно раиемизуется со скоростью 0,1 % в год. У детей в период формирования зубов в дентине содержится толь-ко 1-аспарагиновая кислота. Дентин выделяют из зуба и определяют В нём содержание 0-формы. Результаты теста достаточно точны. Так, для 97-лет-ней женщины, возраст которой был документально засвидетельствован, тест показал возраст 99 лет. Данные исследований, выполненных на ис-копаемых остатках доисторических животных — слонов, дельфинов, мед-ведей, — хорошо согласуются с результатами датирования, полученными радионуклидным методом.
ЗА ЧТО СЕНГЕР ПОЛУЧИЛ НОБЕЛЕВСКИЕ ПРЕМИИ
При гидролизе белков до аминокислот (разрушении пептидной связи во-дой) теряется информация о последовательности их соединения. Поэто-му долгое время считали, что определение первичной структуры белка представляет собой совершенно безнадежную задачу. Но в 50-х гг. XX в. английский биохимик Фредерик Сенгер (родился в 1918 г.) смог расшиф-ровать последовательность аминокислот в полипептидных цепях гормо-на инсулина. За эту работу, на выполнение которой ушло несколько лет, в 1958 г. Сенгер был удостоен Нобелевской премии по химии (двадца-тью годами позже он совместно с У. Гилбертом получил вторую премию за вклад в установление первичной структуры ДНК).
Принципы определения аминокислотной последовательности, впервые сформулированные Сенгером, используются и ныне, правда, со всевоз-можными вариациями и усовершенствованиями. Процедура установле-ния первичной структуры белка сложна и многоступенчата: в ней около десятка различных стадий. Сначала белок расщепляют до отдельных ами-нокислот и устанавливают их тип и количество в данном веществе. На сле-дующей стадии длинную белковую молекулу расщепляют уже не полно-стью, а на фрагменты. Затем в этих фрагментах определяют порядок соединения аминокислот, последовательно отделяя их одну за другой. Расшепление белка на фрагменты проводят несколькими способами, что-бы в разных фрагментах были перекрывающиеся участки. Выяснив поря-док расположения аминокислот во всех фрагментах, получают полную ин-формацию о том, как аминокислоты расположены в белке. К концу XX в. созданы специальные приборы, определяющие последовательность амино-кислот в молекуле белка в автоматическом режиме — секвенаторы (от англ. sequence — «последовательность»).
МОЛОКО И КИСЛОМОЛОЧНЫЕ ПРОДУКТЫ
Молоко представляет собой коллоидный раствор жира в воде. Под микроскопом хорошо видно, что оно неоднородно: в бесцветном растворе (сыворотке) плавают жировые шарики.
В коровьем молоке обычно содержится от 3 до 6 % жиров (в основном это сложные эфиры глицерина и насыщенных карбоновых кислот - пальмитиновой, стеариновой), около 3 % белков, а ешё углеводы, органические кислоты, витамины и минеральные вещества.
Белок казеин в молоке присутствует в связанном виде - ковалентно присоединённые к аминокислоте сери-ну фосфатные группы образуют соли с ионами кальция. При подкислении молока эти соли разрушаются, и казеин выделяется в виде белой творожистой массы. В желудке человека под действием особых ферментов происходит процесс, называемый “створажива-нием казеина”. Створоженный казеин выпадает в осадок и медленнее выводится из организма, а потому полнее усваивается. Казеин высоко питателен:
В нём есть почти все аминокислоты, необходимые человеку для построения собственных белков. В чистом виде он представляет собой безвкусный белый порошок, не растворимый в воде. Помимо него в молоке содержатся и другие белки, например лактальбумин. При кипячении этот белок превращается в нерастворимую форму, образуя на поверхности кипячёного молока характерную белую плёнку - пенку.
Входящий в состав молока сахар лактоза С^НддО, изомерен сахарозе. В организме человека под действием фермента лактазы этот сахар расщепляется на моносахариды глюкозу и галактозу, которые легко усваиваются. За счёт этого, например, грудные дети пополняют запасы углеводов. Интересно, что у многих людей (в основном у представителей монголоидной расы) организм в зрелом возрасте утрачивает способность расщеплять лактозу.
Проходя через пищеварительный тракт, лактоза не усваивается, а становится питательной средой для развития различных болезнетворных микроорганизмов, что приводит к общему недомоганию. Именно поэтому народы Дальнего Востока (японцы, китайцы) практически не употребляют в пишу молочные продукты.
В промышленных условиях молоко подвергают тепловой обработке, цель которой - подавить развитие микроорганизмов и продлить срок его хранения. Для этого молоко пастеризуют - выдерживают 30 мин при 65 °С, а также используют кратковременную термообработку - нагревают в течение 10-20 с до 71 °С. По сравнению с пастеризацией термообработка лучше сохраняет питательные вещества, в первую очередь витамины. Чтобы молоко не расслаивалось на сливки и сыворотку, его гомогенизируют - пропускают под давлением через небольшие отверстия. Жировые шарики дробятся, уменьшаются в размерах, а молоко становится более вязким.
Значительная часть молока идёт на переработку - для производства сливочного масла, сыра и кисломолочных продуктов (кефира, ряженки, простокваши, сметаны).
Чтобы получить кефир, молоко сквашивают - выдерживают в течение 8-10 ч при 20-25 °С, добавляя затравку молочнокислых бактерий. Под их действием лактоза распадается до молочной кислоты:
С„н„о„ + н,о =лактоза == 4СНзСН(ОН)СООН. молочная (2-гидроксипропановая) кислота
Именно молочная кислота определяет специфический вкус кефира. По мере того как она накапливается в растворе, происходит коагуляция (свёртывание)казеина, который выделяется в свободном виде. Поэтому кефир имеет более густую консистенцию, чем молоко. Молочнокислое сбраживание лактозы сопровождается спиртовым брожением, из-за чего в кисломолочных продуктах, в частности в кефире, есть небольшое количество алкоголя (до 0,03 %). В кисломолочных продуктах содержатся также микроорганизмы, которые подавляют развитие болезнетворных бактерий и тем самым улучшают пишеварение.
Творог тоже получают сквашиванием молока молочнокислыми бактериями. Его главной составной частью является белок казеин.
Чтобы приготовить сливочное масло, от молочной сыворотки необходимо отделить капельки жира, входящие в состав молока. Для этого сбивают сливки - верхний, более жирный слой, образующийся при отстаивании молока.
Казеин входит также в состав сыров. Их делают, добавляя в молоко бактериальную закваску и специальные ферменты, а затем подогревая смесь до определённой температуры. В выделившийся сгусток вновь вводят ферменты и подогревают. При этом происходит частичное изменение структуры и состава казеина. Затем смесь раскладывают по формам и длительное время - до шести месяцев - выдерживают при низкой температуре (не выше 15 °С). Во время созревания казеин под действием ферментов распадается на поли-пептиды и свободные аминокислоты. Часть аминокислот окисляется кислородом воздуха, при этом образуются аммиак, альдегиды, а также кетокислоты, придающие сыру характерный аромат.
Скисание молока - привычный пример денатурации белка.
МЕДНАЯ КРОВЬ
В холодных водах Перуанского течения в Тихом океане обитает кальмар Dosidicus gigas. Его сигарообразное тело вместе со щупальцами достигает в длину 3,5 м, а масса гиганта может превышать 150 кг. Мощные мышиы выбрасывают струю воды с силой, с какой она бьёт из пожарного рукава, благодаря чему кальмар способен двигаться со скоростью до 40 км/ч. Клювом, очень крепким и острым, он может перебить стальной кабель. По свидетельству очевидцев, кальмар буквально в клочья раздирает 20-килограммовую рыбину. Этот свирепый хишник очень опасен и для человека. В книге Франка Лейна “Царство осьминога” утверждается, что “человек, упавший за борт в местах, где обитает много кальмаров, не проживёт и полминуты”.
Чтобы “зарядиться” энергией, этому обитателю океана требуется много кислорода - не менее 50 л в час. По-ступаюший из морской воды кислород разносится по телу кальмара с помошью особого белка, содержащего медь, - гемоиианина (от греч. “гема” - “кровь” и “кианос” - “лазурный”, “голубой”).
Стоит заметить, что в крови позвоночных кислород “транспортируют” атомы железа в составе гема - особой сложной молекулы, которая входит в состав белка гемоглобина. Им буквально нашпигованы красные кровяные клетки - эритроциты. Молекула гемоглобина содержит четыре гемовых фрагмента, каждый из которых способен связать молекулу кислорода. В отличие от гемоглобина, в гемоиианине атомы меди непосредственно связаны с белковыми молекулами, которые не включены ни в какие клетки, а свободно “плавают” в крови. Зато одна молекула гемоииани
На способна связать до 200 атомов меди. И ешё одна особенность гемоииани-на - его молекулы имеют огромные даже для белков размеры. У “обычных” белков, входящих в состав яиц, молока, мыши, молекулярная масса колеблется в пределах от б тыс. до 1 млн, а молекулярная масса гемоиианина может достигать 10 млн! Это один из самых крупных белков; больше по размеру и массе только белковые комплексы у вирусов.
Гемоиианин - очень древний белок. Он устроен проще, чем гемоглобин и не так эффективен. Тем не менее при малом содержании кислорода в морской воде гемоиианин довольно успешно снабжает им ткани холоднокровных животных. Так, давление кислорода в жабрах лангуста составляет всего 7 мм рт. ст. (930 Па), а в тканях - 3 мм рт. ст.; причём концентрация этого газа в крови лангуста в 20 раз выше, чем в морской воде.
Кроме кальмаров, кислород переносится “голубой кровью” также у де-сятиногих ракообразных (омары, крабы, креветки). Гемоиианин найден у всех головоногих моллюсков (осьминоги, кальмары, каракатицы), разнообразных улиток, пауков и др. А вот у морских гребешков, устриц и других двустворчатых моллюсков его нет.
Количество гемоиианина в крови может быть самым разным. Так, у шустрых осьминога и мечехвоста (морское животное типа членистоногих) концентрация этого необычного белка доходит до 10 г в 100 мл крови - почти столько же гемоглобина в крови человека. В то же время, у малоподвижного съедобного моллюска морское ушко Hatiotis tuberculata в 100 мл крови всего 0,03 г гемоиианина. Это и понятно: чем более активно животное,
Чем больше кислорода необходимо ему для восполнения энергетических затрат, тем выше в крови концентрация белка, переносящего кислород.
Гемоиианин был открыт в 60-х гг. XIX в., когда биологи заметили, что кровь головоногих моллюсков при прохождении через жабры окрашивается в голубой цвет. А в 1878 г. бельгийский физиолог Леон Фредерик доказал, что голубой цвет вызван реакцией кислорода с медьсодержащим белком, который он назвал гемоиианином. Когда последний теряет кислород, он, в отличие от гемоглобина, становится бесцветным. Примечательно, что всю работу по изучению нового белка Фредерик выполнил в течение одного дня.
Из гемоиианина нетрудно полностью извлечь медь. Аля этого достаточно обработать белок в отсутствие кислорода реактивом, который прочно связывается с ионами одновалентной меди. Таким же способом можно определить содержание меди в гемоиианине. Лишённый этого металла, он теряет способность переносить кислород. Но если потом ввести в раствор белка ионы Си"1", гемоиианин восстанавливает свою физиологическую активность.
Так было доказано, что в отсутствие кислорода медь гемоиианина находится в степени окисления +1. При избытке же этого газа происходит частичное окисление металла. При этом всегда на одну связанную гемоиианином молекулу кислорода приходится два атома меди. Таким образом, кислород окисляет ровно половину атомов меди. Это ещё одно отличие гемоиианина от значительно более распространённого в животном мире гемоглобина, в котором все атомы железа равноценны и имеют заряд +2 как в свободном состоянии, так и в комплексе с кислородом.